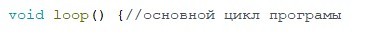Окситоцин стимулирует совсем не любовь
Окситоцин стимулирует людей на подвиги. Это гормон любви, счастья и достатка. По крайней мере, так считалось ранее. Однако, окситоцин не совсем то, чем кажется. Он скорее усиливает определенные стороны человека, нежели самостоятельно генерирует чувства. Так где истина?
Окситоцин стимулирует удовольствие. Или нет?
Окситоцин вырабатывается в организме, закрепляя поведение. Например:
Когда люди обнимаются. Окситоцин в эти моменты вырабатывается организмом, стимулируя людей обниматься чаще и дольше;
Когда люди занимаются любовью. Прекрасный повод повторить приятный опыт;
Когда мать кормит ребенка грудью. Тем самым привязывая его к себе, а себя – к нему.
Но это идеальный мир. В реальном, все обстоит немного сложнее.
Как работает окситоцин
Как и с другими жидкостями организма, у окситоцина несколько применений. Он может быть, как гормоном, так и нейро-гормоном. Всё в зависимости от места в организме, в котором он выделяется. Нас же интересует именно его связь с мозгом.
Окситоцин вырабатывается в гипоталамусе. После чего, транспортируется через мозг в гипофиз. Какое-то время накапливается там, в гипофизе. Чтобы после организм выбросил его в кровоток. Как результат, там он начинает оказывать свое действие.
Также, для работы гормона нужны рецепторы. Они находятся в разных частях тела, в том числе и сердце. Любопытный факт, если во время стресса или нагрузки Вы испытываете счастье, то Ваше сердце укрепляется за счет окситоцина.
Мифы окситоцина
Их не так много, но они есть. В частности, от окситоцина не было зафиксировано ни одной смерти. Следовательно – он не токсичен. Окситоцин не вызывает опухолей и рака. Во время родов его вводят исключительно для поддержания тонуса матки.
Окситоцин нельзя использовать как афродизиак. Скорее даже наоборот. Когда человек получает дозу окситоцина, он вспоминает того, кого любит. Привязывается к этому человеку сильнее. Таким образом можно говорить об окси, как о гормоне здоровых отношений.
Принимать этот препарат самому – смысла нет. Скорее всего организм прогонит гормон через выделительную систему в чистом виде. Препарат покинет Ваш организм вместе с мочой. А также, вместе с потраченными на него деньгами.
Окситоцин стимулирует социальное поведение, как таковое
А вот здесь мы приходим к самому любопытному. Окситоцин не стимулирует чувство любви, как таковое. Он скорее катализатор тех чувств, которые уже кроются в человеке. Окси только проявляет их быстрее.
Относительное действие окситоцина
Итак, Вы рядом с близким человеком. Обнимаете его, вдыхаете запах, Вам приятно рядом с ним. Окситоцин выделяется, и чувство любви усиливается пропорционально. И так первый день, второй, десятый. Исследование этого эффекта было спровоцировано карантином. И вот почему.
Одни пары стали ближе, за период изоляции. А вот другие находятся на стадии развода. Это вызвано, отчасти, тем, что окситоцин просто усилил эмоции партнеров. Вполне может быть, что он изначально не любили друг друга. И теперь это всплыло наружу.
Также окситоцин не вызывает привязанности ко всем подряд, нет. Он работает только в адрес тех, кого Вы знаете лично. Только с близкими людьми, круга Вашего доверия. А вот при встрече с незнакомцем, окситоцин наоборот побуждает к вражде и подозрительности.
Нейрохакинг окситоцином. Насколько уместный?
Абсолютно неуместный. Напрямую окситоцин никак не повлияет на мозг. Он даже вряд ли сможет преодолеть гематоэнцефалический барьер. Единственный способ прокачать мозг окситоцином – вызвать его секрецию.
Пробежки на свежем воздухе, физические нагрузки, чтение книг, умеренный экстрим… Именно такие действия побуждают выделение окситоцина. И только благодаря им, мозг воспитывает в себе привязанность к полезным действиям.
Когда Вы зарабатываете деньги, достигаете результата в сложном деле, учитесь общаться с людьми – окситоцин выделяется в огромных количествах. Это Ваш инструмент для преуспевания практически в любом деле. Отказаться от этого сославшись на: «у меня не получается», это как заходить в интернет и жаловаться: «здесь нет информации».
А что Вы думаете про окситоцин? Есть ли у Вас человек, к которому Вы привязаны? Напишите об этом в комментарии и добавьте сайт в избранное. Пусть он будет Вашей персональной, пусть и скромной, окситоциновой помпой.
Одна треть опрошенных невзлюбила суетливых людей
Ученые из Канады и Бельгии полагают, что результаты их исследования с участием свыше четырех тысяч человек можно экстраполировать на большее число людей. Таким образом, до одной трети населения может быть чувствительна к суетливости окружающих.
Волнение во время экзаменов / ©Getty images
Мизокинезия — психологический феномен, характеризующийся сильной эмоционально-негативной реакцией на мелкие повторяющиеся движения других людей вроде беспокойного дерганья рукой или ногой. По сути, это нелюбовь к суете. Международная группа ученых, в которую вошли специалисты из университетов Британской Колумбии (Канада) и Гентского (Бельгия), заявляют, что научных исследований этого странного явления нет.
Они решили восполнить пробел и провели опросы с участием онлайн-группы. Результаты опубликованы в журнале Scientific Reports. Всего в исследовании приняли участие 4100 человек (преимущественно студенты), которых протестировали на тему их чувствительности к мизокинезии.
Первый опрос был посвящен оценке распространенности чувствительности к этому феномену, второй — к так называемой мизофонии (нелюбви к повторяющимся звукам: жеванию, сопению, постукиванию пальцами по столу, напеванию себе под нос). Кроме того, участников попросили рассказать о себе и оценить эмоциональные и социальные последствия мизокинезии.
Выяснилось, что примерно одна треть опрошенных с неприязнью относилась к суетливым действиям других. Они испытывали гнев, беспокойство или даже разочарование. А социальные последствия вылились в трудности взаимодействия с такими людьми в плане работы и учебы. Исследователи говорят, что с возрастом сензитивность только усиливается, о чем свидетельствуют опросы пожилых.
Ученые надеются также выяснить, влияют ли на чувствительность к мизокинезии зеркальные нейроны, ведь они активизируются, когда человек или объекты вокруг него движутся. Мы как бы начинаем «отражать» такие движения в нашем мозгу. Это связано с эмпатией: когда человек видит чужую боль, то инстинктивно может напрягаться или вздрагивать, будто испытывает эмоции другого и сопереживаем ему. Причина, по которой люди суетятся, — в том, что они нервничают: волнение передается другим, а это не может нравиться.
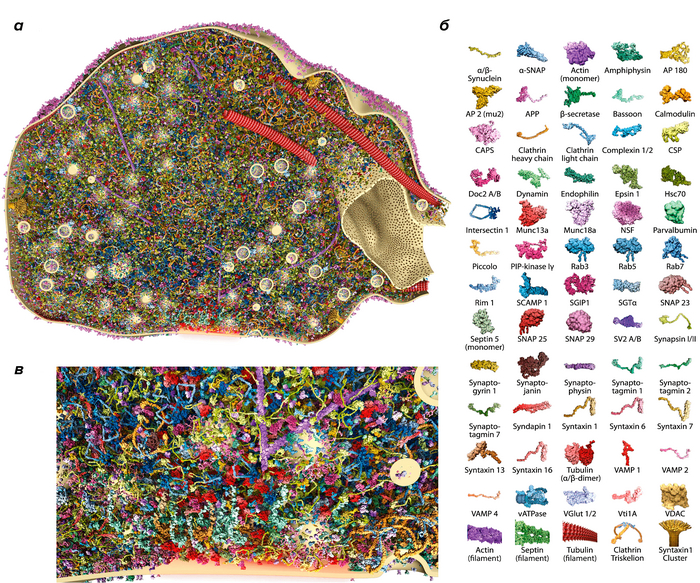
В полном объеме: синаптические везикулы в трехмерной модели синапса. ( атомарная модель части клетки нейрона )
Синаптические везикулы обеспечивают связь между нейронами, а значит, их изучение является необходимым для понимания того, как функционирует нервная система. Кроме того, везикулы являются моделью для изучения общих для всех клеток механизмов клеточного транспорта. Новая трехмерная модель синапса включает 300 тысяч белков в атомарном разрешении. Эта подробная модель открывает новые возможности для изучения тонких механизмом работы синаптических везикул.
По приблизительным оценкам, в среднем в эукариотической клетке содержится 7,9×109 молекул белков . Удивительно, но такое огромное число молекул не ведет к хаосу и неразберихе, а обеспечивает точное выполнение всех клеточных функций, в которых у каждой молекулы есть свои место и задача. Благодаря подробному изучению различных клеточных процессов и молекулярных путей, ученые проникают все глубже в понимание тонкой клеточной организации. Важное место в таких исследованиях занимает исследование работы синаптических пузырьков (везикул), ведь они не только являются основой функционирования нашей нервной системы, но и представляют собой модель для изучения общих принципов мембранного транспорта. Не даром в 2013 году за исследования везикулярного транспорта вручена Нобелевская премия по физиологии и медицине.
Синаптические везикулы — это маленькие мембранные пузырьки, находящиеся в синаптических окончаниях нейронов (особые расширения на концах нейронных отростков, обеспечивающие связь между нейронами). Синаптические везикулы заполнены медиаторами — химическими веществами, которые изменяю работу нейронов. Когда везикулы сливаются с мембраной синаптического окончания, медиатор попадает в щель между синаптическими окончаниями двух нейронов и таким образом передает сигнал от одного нейрона к другому. Благодаря тому, что все синаптические везикулы сконцентрированы в синаптических окончаниях, их легко выделять из изучаемых тканей для анализа. Поэтому именно судьба синаптических везикул — это один из самых хорошо изученных сейчас клеточных путей.
Известно, что он состоит из трех этапов. Сначала пузырек прикрепляется к специальному участку синаптической мембраны — активной зоне (этот этап называется докинг). Потом он подготавливается к слиянию с синаптической мембраной (прайминг) и, в конце концов, сливается с ней, высвобождая медиатор в синаптическую щель (экзоцитоз). Параллельно на синаптической мембране происходит эндоцитоз с образованием пузырька, который постепенно обеспечивается всеми необходимыми молекулами и медиатором для восполнения запаса везикул.
Для того, чтобы более полно описать работу синаптической везикулы и синаптичсекого окончания, необходимо подробно изучить ее молекулярное строение и белковый состав. Первая модель синаптического пузырька с атомным разрешением появилась еще семь лет назад. В этой работе ученым удалось изучить некоторые особенности устройства везикулы, — например, они обнаружили, что белковые молекулы занимают около 20% поверхности мембраны везикулы, и при этом липидные компоненты мембраны представлены, по больше части, «жесткими» малоподвижными липидами. Новая работа ученых из Гёттингена позволила дополнить эти данные и подробно охарактеризовать соотношение различных белковых молекул внутри синаптического пузырька
Группа исследователей под руководством Силвио Риццоли использовала комплексный подход, объединив количественный иммуноблоттинг, масс-спектрометрию, электронную микроскопию и флуоресцентную микроскопию высокого разрешения, что позволило им охарактеризовать не только количество разных белков в везикулах и в цитоплазме вокруг них, но и их расположение внутри синаптического окончания. На первом этапе своего исследования они выделили синаптические окончания из образцов мозга крысы. Сделать это можно с помощью центрифугирования в градиенте полисахарида (в данной работе был использован синтетический полисахарид Ficoll, но подобный эксперимент можно провести и с обыкновенной сахарозой).
Разные компоненты клетки имеют разную плотность, поэтому, если разрушенные клетки (гомогенат) поместить в пробирку с несколькими слоями растворов сахара разной концентрацией и начать вращать на центрифуге, органеллы распределяться по этим слоям, выбирая слой с близкой плотностью. При разрушении нервных клеток синаптические окончания отрываются от нейронных отростков и образуют так называемые синаптосомы, которые можно обнаружить в слое с 9% концентрацией полисахарида Ficoll (рис. 1). Полученный образец синаптосом исследователи, прежде всего, изучили с помощью электронного микроскопа. Это помогло охарактеризовать пространственные параметры синаптосом: их размер, количество синаптических пузырьков в одной синаптосоме, объем этих пузырьков.
Убедившись, что процедура выделения синаптосом не изменила содержащееся в них количество белков, ученые вычислили концентрацию 62 различных белков с помощью количественного иммуноблоттинга. Суть этого метода заключается в сравнении количества каждого из белков в экспериментальном образце и в контрольных образцах с заранее известной концентрацией белка. Полученные результаты хорошо согласовывались с более ранними исследованиями. Отклонение было обнаружено только для белка SV2 (synaptic vesicle 2): в данном исследовании его количество было оценено как 12 копий на один синаптический пузырек, тогда как в других исследованиях — 1,7 и 5 копий.
Метод иммуноблоттинга основан на работе антител, которые распознают только целые белки, содержащие определенную последовательность аминокислот. При этом, если часть белков при приготовлении экспериментального образца (гомогената клеток) была разрушена и/или утратила необходимую аминокислотную последовательность, эта фракция белков не будет распознана. Именно поэтому иммуноблоттинг помог исследовать только около 40,5% общего содержания белков в синаптосомах. Для того, чтобы сделать оценку количества белков более точной, исследователи обратились к количественной масс-спектрометрии — к методу iBAQ (intensity-based absolute quantification, основанный на интенсивности полный подсчет). iBAQ вычисляет количество того или иного белка, учитывая все пептиды, которые могли появиться при его разрушении.
Использование этого метода помогло увеличить долю проанализированных белков до 88,4%, при этом результаты хорошо коррелировали с данными, полученными при иммуноблоттинге.
Внутренним контролем служило то, что белки, образующие различные белковые комплексы (например, структурные белки везикулярных кластеров или белки активной зоны) были обнаружены в правильных соотношениях. Интересным и неожиданным открытием оказалось то, что количество белков, задействованных на разных этапах везикулярного цикла, разительно отличается. Количество белков комплекса SNARE (необходимого для слияния синаптического пузырька с синаптической мембраной) составляло 20–26 тысяч копий в одной синаптосоме, хотя для экзоцитоза одной везикулы достаточно 1–3 копий этого комплекса. При этом в одной синаптосоме всего около 4 тысяч молекул клатрина и около 2,3 тысяч молекул динамина. Для работы одного синаптического пузырька нужно 150–180 копий клатрина, а значит, всего клатрина, который присутствует в одном синапсе, хватит для экзоцитоза только 7% везикул этого синапса. Аналогичные расчеты для динамина показывают, что его количество достаточно для экзоцитоза всего 11% везикул. При этом количество белков, необходимых для эндоцитоза везикул (для замешения использованных пузырьков), было еще ниже — от 50 до 150 копий.
Для того, чтобы объяснить эти неожиданные результаты, ученые предположили, что для некоторых белков их точное расположение в месте использования может компенсировать недостаточное количество копий. В то же время, белки, количество которых оказалось удивительно большим, могут располагаться в синапсе очень рассеянно, поэтому в каждом конкретном месте синапса их концентрация будет низкой. Проверить эти предположения исследователям помогло использование флуоресцентной микроскопии высокого разрешения — метода STED-микроскопии (Stimulated Emission Depletion Microscopy, микроскопия на основе подавления спонтанного испускания). В качестве контрольных образцов ученые использовали культуру нейронов гиппокампа и нервно-мышечное окончание взрослых крыс.
С помощью флуоресцентной микроскопии было изучено расположение 62 различных белков относительно активной зоны синапса и везикулярного кластера (скопления везикул в синаптическом окончании). Оказалось, что большинство белков распределено в объеме синапса более-менее равномерно (учитывая, что большинство белков активной зоны находится в активной зоне, а везикулярный кластер занимает почти весь объем синаптосомы). Таким образом, компенсация за счет особенностей распределения для белков синапса не характерна, а значит, вопрос о том, почему количество копий одних белков значительно больше количества копий других, остается открытым.
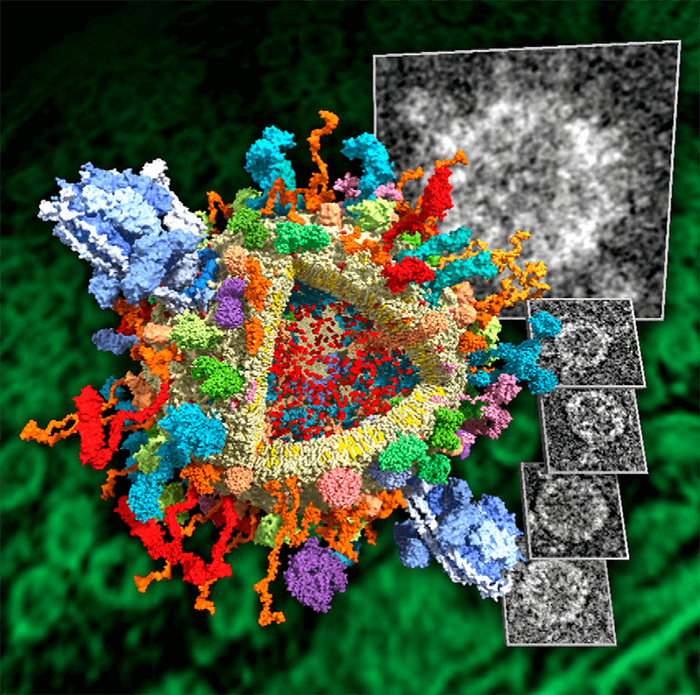
Полученные с помощью STED-микроскопии данные помогли исследователям построить трехмерную реконструкцию синаптического окончания, содержащую 60 различных белков (рис. 3). Все белки были смоделированы с атомарной точностью и расположены в характерных участках синапса, в соответствии с полученными экспериментальными результатами и литературными данными. Эта модель демонстрирует, что синаптическое окончание достаточно плотно заполнено везикулами, что, вероятно, препятствует свободному перемещению молекул и органелл. Возможно, что большое количество копий некоторых белков является эволюционным приспособлением к этой особенности строения синаптического окончания, помогающим обеспечить быстрое высвобождение медиатора в синаптическую щель. При этом образование новых везикул взамен использованных (эндоцитоз) может проходить гораздо медленнее без вреда для функционирования синапса. Это может объяснить небольшое количество копий эндоцитозных белков. При этом для того чтобы обеспечить нормальную работу синаптического окончания, нужно иметь большой запас готовых везикул, что и показывают результаты трехмерной реконструкции.
Трехмерная реконструкция синапса
Рисунок 3. Трехмерная реконструкция синапса. а — Срез через синаптическое окончание. Изображение содержит 60 белков, которые расположены в количестве копий и местоположениях, определенных с помощью микроскопии. б — Белки, указанные на реконструкции синапса. в — Увеличенное изображение активной зоны.
Полученные немецкими учеными результаты позволяют более подробно описать функционирование синаптического окончания и работу системы везикулярного транспорта. Стало понятно, что в условиях высокой плотности везикул, количество и расположение белков в синаптическом окончании должно строго контролироваться. Но на вопрос о том, каким образом контролируется количество копий каждого из белков, предстоит ответить новым исследованиям. Осуществляется ли этот контроль на уровне транскрипции, трансляции или транспорта этих белков от тела нейрона к синаптическому окончанию? Возможно, что важную роль в этом контроле играют сами синаптические везикулы, которые могут связывать свободные белки и, таким образом, снижать их концентрацию в цитоплазме. Более подробно предстоит изучить и особенности регуляции трансмембранных белков синаптических пузырьков, которым было уделено немного внимания в описанной работе.
За последние два десятилетия компьютерные технологии начали вносить значительный вклад во все естественные науки, в том числе и в биологию. Наряду с масштабным анализом больших объемов данных и компьютерным моделированием различных биологических процессов, все большие обороты набирает научная визуализация, которая является областью компьютерной графики. Если на ранних этапах развития этой области ученым удавалось создавать только трехмерные модели белков и некоторых других молекул, то сейчас вычислительные мощности позволяют моделировать сравнительно крупные объекты — большие молекулярные комплексы и целые вирусы.
Отличным примером результатов научной визуализации могут послужить работы российской компании Visual Science в их проекте «Зоопарк вирусов» — самые подробные на данный момент научно достоверные модели ВИЧ и вируса гриппа. Специалисты Visual Science объединяют данные огромного количества работ по молекулярной биологии, вирусологии и кристаллографии, мнения экспертов ведущих научных центров мира и результаты молекулярного моделирования, полученные научным отделом компании.
О другом примере детальной научной визуализации было рассказано в этой статье. Уже сейчас можно утверждать, что такие подробные трехмерные модели помогают ученым получить более общий взгляд на изучаемый объект, обнаружить новые закономерности в его строении и функционировании. Несомненно, что в ближайшем будущем область применения научной визуализации будет расширяться, помогая исследователям совершать новые открытия.
Ответ на пост «У меня БАС (болезнь Стивена Хокинга)»6
В прошлом году от этой заразы умерла любимая родная тетя. Началось всё с потягивания речи. Думали, что последствия незарегистрированного микроинсульта, который она пережила на ногах после смерти мужа. Лечиться не хотела, боялась диагноза. Потом, когда речь уже стала на уровне интонации под общими уговорами начала обследования, ездили в Москву в НИИ Неврологии на Волоколамском шоссе. Там уже подтвердили диагноз - БАС. Потом в Питере пролежала недельный реабилитационный курс в Институте мозга человека РАН по полису, кстати хороший поддерживающий курс. Покупали поддерживающие таблетки в Турции, которые в России только на авито можно купить, в аптеках тупо нет. У нас даже появилась надежда. Но к сожалению у неё болезнь началась не с конечностей, а сразу с мозга. Сгорела, буквально, за полгода. Печально всё это. Как будто рака не хватало, чтоб выкашивать население. Теперь от каждого десятого слышу про БАС.
Стэнфордские ученые обратили симптомы аутизма у мышей
Ученые Стэнфорда сообщили о прорыве: им удалось обратить ключевые симптомы аутизма у мышей, воздействуя на ретикулярное ядро таламуса — участок мозга, который действует как «привратник» сенсорной информации. Экспериментальный препарат Z944, изначально разработанный для лечения эпилепсии, устранил гиперчувствительность к раздражителям, склонность к судорогам и повторяющееся поведение у животных.
Исследование показало, что гиперактивность ретикулярного ядра таламуса нарушает фильтрацию сенсорных сигналов и запускает поведенческие проявления, ассоциированные с расстройствами аутистического спектра. Когда ученые снизили активность этой области, сенсорная «перегрузка» и повторяемые действия исчезали, а судорожная готовность снижалась, что указывает на ключевую роль этого узла в регуляции входящих стимулов.
Препарат Z944 относится к классу блокаторов Т‑типовых кальциевых каналов и ранее разрабатывался как противоэпилептическое средство. В новой работе его эффект оказался шире: таргетированное подавление гиперактивности ретикулярного ядра восстановило баланс сигналов в таламо-кортикальных цепях и сняло поведенческие нарушения в модели аутизма.
Редакция обращает внимание, что данные получены на животных, а аутизм у людей представляет собой сложное и неоднородное состояние. Для подтверждения эффективности и безопасности подхода необходимы клинические испытания, включая оценку дозировок, длительного применения и возможных побочных эффектов. Тем не менее результаты открывают перспективу репозиционирования противоэпилептических препаратов для терапии аутизма и указывают на ретикулярное ядро таламуса как на многообещающую терапевтическую мишень.
Перцептрон
Предлагаю Вашему вниманию пример перцептрона реализуемым на ардуино.
Перцептрон является минимальной ячейкой нейросети.И так что бы не лить лишнюю воду приступим. Для реализации будет использована платформа ардуино уно.
Начнем !
Сконфигурируем входы нейрона.
Устанавливаем первоначальные веса нейрона.
Устанавливаем первоначальное состояние нейрона.
Первоначальное состояние на входе и выходе нейрона.
Конфигурируем порты программы.
Устанавливаем скорость серийного порта 9600 бод а также подтягиваем две кнопки на внутреннее сопротивление командой INPUT_PULLUP и конфигурируем выход нейрона на 13 пин ардуино (можете назначить любой свободный порт также как входные нейроны).
Основной цикл программы.
Основная программа обработки сигналов в самом нейроне и формирование выходного ответа после получения входных данных.
Обработка сигналов на входе нейрона, в принципе поэкспериментировав с кодом, вы сможете подать сигналы с чего угодно, нейрону все равно какие данные вы подадите на вход.
Полный листинг приведен ниже, пользуйтесь и осваивайте. Сфера применения ограничена только вашей фантазией.
Старался максимально объяснить каждую строчку кода. Сам знаю как новичкам или даже опытным программистам разберётся с чужим кодом или пытаться его адаптировать под свой проект. В дальнейших статьях постараюсь показать где я его применяю на практике. Занимаюсь Нейросетями давно и буду выкладывать свои наработки по мере возможности и время. Вопросы и комментарии можете оставлять если будут какие то вопросы то постараюсь на них ответить.
// Вход нейрона
const int en1 = 12;//определяем вход нейрона
const int en2 = 11;//определяем вход нейрона
const int z_out = 13;//определяем выход нейрона
// Веса нейрона
float w1 = 0.5;//определяем веса нейрона
float w2 = 0.3;//определяем веса нейрона
float theta = 0.6;// сдиг нейрона для предотвращения переобучения
float z = 0;//начальное состояние нейрона
//Состояние входа и вихода нейрона
int x1 = 0;//определяем состояние на входе нейрона
int x2 = 0;//определяем состояние на входе нейрона
int zr = 0;//определяем состояние на выходе нейрона
void setup() {//Конфигурация портов програмы
Serial.begin(9600);//скорость роботы порта
pinMode(en1, INPUT_PULLUP);//вход первого порта
pinMode(en2, INPUT_PULLUP);//вход второго порта
pinMode(z_out, OUTPUT);//выходной порт
}
void loop() {//основной цикл програмы
neyron();//обработка сигналов в самом нейроне
z = ((x1 * w1) + (x2 * w2)) - theta;//перещитываем состояния на входе нейрона
if (z >= 0)//если состояние нейрона после перещета больше 0 то...
{
digitalWrite(z_out, HIGH);//на цыфровом пине устанавливаем состояние
zr = 1;//пишем выход нейрона как высокий
}
else//если нет то...
{
digitalWrite(z_out, LOW);//на цыфровом пине устанавливаем состояние
zr = 0;//пишем выход нейрона как низкий
}
Serial.print("x1 = ");//выводим в серийный порт надпись
Serial.print(x1);//выводим в серийный порт состояние первого входа
Serial.print("x2 = ");//выводим в серийный порт надпись
Serial.print(x2);//выводим в серийный порт состояние второго нейрона
Serial.print("zr = ");//выводим в серийный порт надпись
Serial.print(zr);//выводим состояние нейрона на выходе
delay(50);//утанавливаем задержку
}
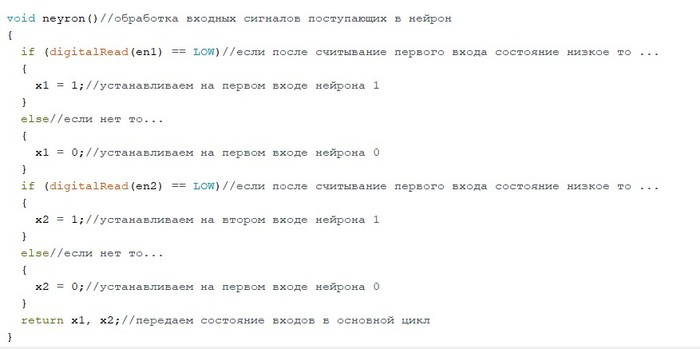
void neyron()//обработка входных сигналов поступающих в нейрон
{
if (digitalRead(en1) == LOW)//если после считывание первого входа состояние низкое то ...
{
x1 = 1;//устанавливаем на первом входе нейрона 1
}
else//если нет то...
{
x1 = 0;//устанавливаем на первом входе нейрона 0
}
if (digitalRead(en2) == LOW)//если после считывание первого входа состояние низкое то ...
{
x2 = 1;//устанавливаем на втором входе нейрона 1
}
else//если нет то...
{
x2 = 0;//устанавливаем на первом входе нейрона 0
}
return x1, x2;//передаем состояние входов в основной цикл
}