Вакцины от рака
Вирусолог из Хорватии Беата Халасси столкнулась с раком молочной железы. И наряду с обычными методами лечения она решила попробовать нечто революционное. Беата вводила прямо в опухоль онколитические вирусы – вирусы, которые преимущественно заражают и убивают раковые клетки. Терапия состояла из введения в опухоль вакцинного штамма вируса кори, а затем штамма вируса везикулярного стоматита. Причем оба вируса были выращены в ее собственной лаборатории. А изменения опухоли в процессе эксперимента тщательно фиксировались.
После двух месяцев вирусной терапии опухоль уменьшилась и перестала прорастать в кожу и мышцы – превратилась в операбельную. Так что ее просто удалили хирургическим путем. Затем Беата еще год принимала препарат трастузумаб на основе антител – стандартный в онкологии. И вот даже спустя 45 месяцев после операции у нее не наблюдается никаких признаков рецидива.
Беата – не просто безумный биохакер. Все это она делала с разрешения и под наблюдением своих онкологов, которые тщательно следили за ее состоянием и были готовы вмешаться, если эксперимент пойдет не по плану. Тем не менее, работу Халасси долго не хотели публиковать. Она отправляла полученные данные во многие журналы, но получала сплошные отказы. И дело не в том, что кто-то сомневался в научной состоятельности ее работы. Да, это описание одиночного кейса, которое не может служить доказательством эффективности методики, а после не значит вследствие. Но такие кейсы регулярно публикуются и помогают двигать науку вперед.
Издания беспокоило, что подобный прецедент побудит других пациентов заниматься такими экспериментами. И это будут люди с куда меньшим пониманием рисков и без необходимого надзора со стороны врачей. Ведь то, что эта методика, возможно, помогла Беате, еще не значит, что она поможет другим, а не сделает, например, хуже. Увы, Ведь многие интересные в теории концепции в итоге проваливаются во время клинических исследований. И не просто так придумали доказательную медицину со всеми ее правилами и протоколами.
Но все же в 2024 году журнал Vaccines одобрил публикацию.
Онколитические вирусы, которые опробовала на себе Беата – это одна из тех вещей, которые в СМИ громко называют «вакциной от рака». Вы наверняка видели и такие заголовки: “Ученые разработали универсальную вакцину от рака”, “Ученые разработали вакцину от всех видов рака”, “Российские ученые выпустили первые тестовые серии вакцины от рака”, «Россия произвела первые вакцины от рака». Если так посмотреть, кажется, что будущее уже наступило. Причем в России.
По последним данным, в 2023 году в России от рака умерло около 284 тыс. человек, что составляет почти 16,1% всех смертей в стране. Рак является второй по частоте причиной смерти после сердечно-сосудистых заболеваний. Так что тема эта для людей очень важная и острая. Именно поэтому в эти оптимистичные заголовки хочется верить. Но практика показывает, что в теме вакцин от рака существует множество недопониманий, ведь СМИ смешивают в кучу несколько разных подходов. Придется разбираться и отделять реальные открытия от домыслов.
Предотвращение рака с помощью вакцин
На самом деле большинство так называемых вакцин от рака – это либо не совсем вакцины, либо не совсем от рака. Настоящие вакцины в нашем понимании – это препараты, состоящие из целых или ослабленных патогенов или их частичек, предназначенные для стимуляции иммунитета. Вакцины обычно что-то предотвращают. И да – существуют вакцины, которые состоят из частичек патогенов и при этом имеют доказанную эффективность именно в предотвращении рака. Хотя это все же вакцины не от рака. Сначала поговорим о них, а потом уже о не совсем вакцинах, но именно от рака.
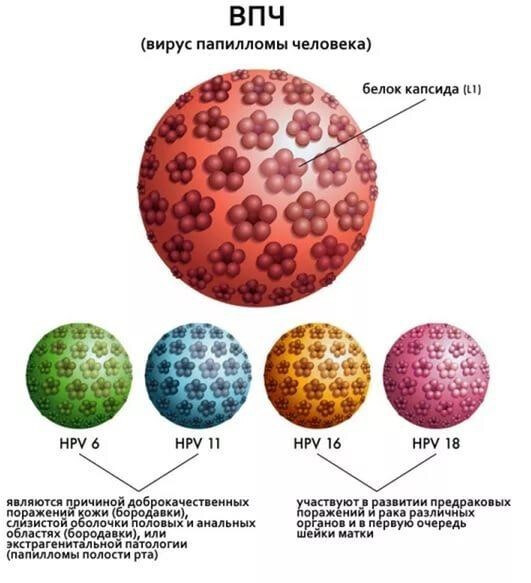
Во-первых, есть вакцина против вируса папилломы человека.
Эти вакцины предотвращают заражение вирусом, который со временем может привести к развитию рака шейки матки, анального отверстия, рака пениса, а также горла и миндалин. 99% случаев рака шейки матки вызывает именно ВПЧ, а не что-то еще. Не психические конфликты, как, увы, считают некоторые далекие от науки люди.
Другой пример – вакцина от вируса гепатита B.
Здесь принцип тот же самый. Гепатит B в хронической форме ведет к значительному увеличению риска рака печени. В большинстве случаев рака печени виноват именно гепатит.
Есть еще одна вакцина, которая даже из этого ряда выбивается – это вакцина против туберкулеза БЦЖ.
Во-первых, туберкулез повышает риск рака легких и некоторых других видов рака. Тут все аналогично: лучше не заражаться. Но оказалось, что у вакцины от туберкулеза есть бонус – она довольно эффективна в борьбе с карциномой мочевого пузыря. Это подтверждается хорошими данными, в том числе девятью рандомизированными исследованиями с участием около 700 пациентов с карциномой.
В этих работах терапию вакциной против туберкулеза сравнивали с внутрипузырной химиотерапией. С вакциной полный ответ на лечение был достигнут у 68% пациентов – по сравнению с 51% в группе химиотерапии. Полный ответ означает, что признаки опухоли не обнаруживаются при всех доступных методах обследования.
Спустя три с половиной года после лечения почти каждый второй пациент после БЦЖ не имел признаков болезни. А при химиотерапии – лишь каждый четвертый. И это не какая-то альтернативная медицина. Сейчас БЦЖ – практически золотой стандарт лечения карциномы мочевого пузыря. Метод одобрен FDA, в России тоже официально одобрен. Вот так у вакцин даже побочки могут оказаться полезнее и эффективнее всякой там гомеопатии.
Почему это работает? Возможно, дело в общей стимуляции иммунного ответа. Еще в 1890-х гг. американский хирург Уильям Коли заметил, что у пациента с неоперабельной саркомой произошло уменьшение опухоли после случайного заражения бактерией Streptococcus pyogenes. Коли пришёл к выводу, что инфекция, сопровождающаяся высокой температурой, может вызвать регрессию рака. Тогда он начал намеренно заражать своих пациентом тем же патогеном, но эффект был слишком непредсказуем. Оригинальный метод Коли не нашел популярности в онкологии – но послужил толчком к развитию иммунотерапии рака.
Так вот, противотуберкулезная вакцина стала первой успешной противоопухолевой вакциной в мире. Хотя, может, ее правильней называть иммунотерапевтическим препаратом. Так что, если посмотреть на проблему с такой стороны, то вакцина от рака – это история совсем не новая. Поэтому давайте уже обсудим, о каких современных исследованиях все говорят в последние годы?
Онколитические вирусы
Для начала вернемся к кейсу Беаты Халасси, которая на себе опробовала онколитическую виротерапию. В чем же механизм этого метода – и как он вообще связан с вакцинами? Главное сходство с некоторыми вакцинами в том, что здесь пациенту вводят вирусы в организм. Вот только вакцина – это превентивное средство, предотвращающее заболевание. А онколитическая виротерапия – лечение.
Хотя в обоих подходах мы так или иначе вызываем мощный иммунный ответ. В случае с вакциной в этом и цель. А вот в случае введения онколитических вирусов задача хитрей: надо сделать опухоль более заметной для иммунной системы.
Онколитические вирусы избирательно размножаются в опухолевых клетках, вызывая их разрушение. Наружу выходят опухолевые антигены – молекулы, распознаваемые иммунной системой как чужеродная угроза. Иммунная система наконец-то видит цель, которая до этого могла от нее скрываться. Цель подсвечивается как противник в компьютерной игре. Научившись распознавать мертвые раковые клетки, иммунная система атакует уже и активные клетки опухоли.
И вот появляются разработки, обещающие с помощью онколитических вирусов победить даже очень тяжелые и плохо излечимые формы рака. Например, есть глиобластома – одна из разновидностей опухолей мозга.
Глиобластома развивается не из нейронов, а из вспомогательных, глиальных клеток, преимущественно из звездообразных астроцитов или их предшественников. То есть из клеток, которые в норме выполняют поддерживающие функции для нейронов. Глиобластома – самая агрессивная и злокачественная форма глиомы. С 2017 по 2021 в США диагностировали в среднем около 13 073 случаев глиобластомы в год. В России каждый год диагностируют примерно 32 100 новых случаев первичных опухолей ЦНС. Глиобластомы составляют 15,6 % от этого числа.
Особо опасной эту опухоль делает специальный белок на ее поверхности, помогающий ей выдать себя за нейрон – чтобы иммунная система не обижала. Белок называется CD155 – и в норме он является одним из белков-чекпоинтов, который как бы притормаживает иммунную систему. Вот представьте: участковый проверяет подозреваемого на участие в вооруженном нападении. А он ему диплом кандидата философских наук показывает – мол, я интеллигенция, какое еще нападение! И участковый уходит, так и не узнав, что вместе с дипломом наш кандидат купил пару автоматов, гранатомет и бочонок напалма. И вообще он не философ, а гопник в законе.
Коварная глиома притворяется нейронами с помощью этого белка, чтобы и иммунная система считала ее безобидной интеллигенцией. Но тут на сцену приходят онколитические полиовирусы. Вот что делает полиомиелит: он, помимо прочего, вызывает у людей серьезные повреждения мозга.
Размножается в нервных клетках, прежде всего в мотонейронах, передающих сигналы двигательной системе, из-за чего порой вызывает паралич. А как он распознает эти мотонейроны? По белку CD155. То есть по тому самому “диплому философа”.
Но что, если полиовирус изменить? Сделать так, чтобы он все еще выискивал белок CD155, но настоящие нейроны не обижал? Мочил только “фейковых философов”, раковые клетки. Тут и появляется генно-инженерное решение.
Секрет полиовируса – в его размножении. Когда вирус заражает клетку, ему нужно, чтобы клетка воспроизводила его копии в как можно большем количестве. Но полиовирус – очень маленький вирус, у которого очень мало генов и очень мало инструментов. Но огромные амбиции.
Как и у всякого вируса, у него есть белковый капсид. Это одновременно и его пальто, и средство передвижения. Каждому маленькому вирусу, выходящему из клетки, нужно такое. Хорошо бы заставить клетку эти капсиды производить, а для этого заставить ее белковые фабрики работать на себя. Для этого можно подсунуть клетке чертеж-инструкцию в виде молекулы РНК.
Казалось бы, отдал чертеж на фабрику – и все готово. Клетка сама будет шить тебе пальто. Но эукариотическая клетка свои родные чертежи оснащает специальной печатью – она называется кэп. Без неё чертежи на клеточные фабрики не принимают. А у маленького полиовируса на его РНК-инструкциях такой печати нет. И научиться делать печати он не может – слишком он маленький и слишком это сложно.
Поэтому полиовирус просто берет и объявляет, что отныне в клетке все работает наоборот. Устраивает революцию! Есть печать? Запрещаем такой чертеж на всех фабриках! Вот у меня, говорит вирус, нет никакой печати. Я один хороший. Так что пускайте меня на фабрику! Фабрики вирусам!
Но есть нюанс. Дело в том, что работает этот план маленького полиовируса далеко не со всеми клетками. Большинство клеток слишком тупые, чтобы понять смысл революции. Нужны клетки-нейроны. Вот их и удается взломать и заставить шить полиовирусу теплое пальто. Зато в таких зараженных нейронах клетки не производят вообще ничего – только новые полиовирусы.
А теперь ход ученых. Берем революционные листовки полиовируса, но слегка меняем. Наш новый маленький революционный герой по-прежнему ищет, как он думает, уязвимых нейронов-философов, согласных на его революцию. По-прежнему распознает их по диплому, белку CD155 на их поверхности. Но в его революционных листовках добавлено два слова, запретных для любого настоящего философа – “Гегель лох”. Попадает такой полиовирус-революционер в настоящего нейрона-философа – и сразу распознается как засланный казачок. Но клетка глиобластомы лишь имитирует мудрость, никаких Гегелей она знать не знает, но пытается притворяться умным нейроном, поэтому слепо верит революционным речам. В итоге вирус их всех убивает.
Так и появился PVSRIPO – модифицированный вирус полиомиелита для борьбы с злокачественными глиомами, включая глиобластому.
В настоящее время он является объектом клинических исследований, проводимых в Университете Дьюка. Его вводят в опухоли пациентов с рецидивирующей злокачественной глиомой четвертой стадии и наблюдают за результатами. Исследования в этой области крайне актуальны, так как прогнозы у пациентов с подобным диагнозом неутешительные, а подтвержденного и достаточно эффективного метода лечения еще нет. Исследования PVSRIPO пока находятся на ранней стадии, но полученные данные уже можно назвать интересными.
Например, в одном клиническом исследовании проверяли безопасность и дозировку PVSRIPO. В нем приняли участие более 60 пациентов. Выяснилось, что препарат не проявляет нейровирулентности, то есть не повреждает настоящие нейроны. При этом выживаемость пациентов, получавших PVSRIPO, оказалась выше, чем обычно бывает при таком диагнозе. Примерно у 21% больных, принимавших PVSRIPO, жизнь сохранилась через 2 и даже через 3 года после лечения.
Эти цифры необычайно высоки для столь тяжелого заболевания. Обычно выживаемость через 3 года – 4%. То есть такой диагноз практически означает, что человеку осталось жить не больше 3 лет. Именно поэтому столько надежд возлагают на PVSRIPO и его аналоги.
Ведутся работы и с другими вирусами. Вот, например, Talimogene laherparepvec – это генетически модифицированный вирус герпеса, используемый против меланомы в случае, когда она уже распространилась по телу и не поддается хирургическому удалению. Из генома вируса ученые удалили два гена, чтобы сделать его безопасней. Первый удаленный ген отвечал за подавление защитных механизмов клетки, а другой помогал вирусу уклоняться от иммунного ответа.
Взамен в вирус был добавлен ген, кодирующий человеческий белок GM-CSF, который привлекает и активирует дендритные клетки и макрофаги, усиливая противоопухолевый иммунный ответ. Выходит, что в начале мы делаем вирус безобидным, убирая все лишнее. А затем добавляем то, что поможет стимуляции иммунной системы.
Получившийся препарат действует за счет размножения вируса внутри раковых клеток, что приводит к их разрушению. При этом вирус параллельно стимулирует иммунный ответ против опухоли. Препарат уже одобрен для использования в США и Европе.
В клиническом исследовании пациенты с меланомой, получавшие онколитический вирус talimogene laherparepvec, в среднем жили дольше, чем те, кому в контроле вводили только иммунный фактор GM-CSF. Медианная выживаемость составила около 23 месяцев против 19. Но особенно заметной оказалась разница в глубине ответа на лечение. Почти 17% пациентов на вирусной терапии достигли полного исчезновения опухоли, тогда как в контрольной группе такой эффект был зафиксирован лишь у одного пациента. Именно эти результаты сделали препарат первым онколитическим вирусом, который дошёл до официального одобрения для лечения рака.
Порой данные вокруг онколитических вирусов действительно обнадеживают. В 2022 году FDA одобрило генную терапию на основе аденовирусного вектора nadofaragene firadenovec-vncg. Торговое название уже попроще – Adstiladrin.
Он применяется для лечения пациентов с немышечно-инвазивным раком мочевого пузыря высокого риска, который не поддается стандартному лечению. Этот препарат стал первой одобренной генной терапией на основе аденовирусного вектора и первой одобренной генной терапией для лечения рака мочевого пузыря.
В клиническом исследовании этой вакцины приняло участие 98 пациентов. Раз в три месяца им вводили препарат. И у 50% участников уже через три месяца после первого введения препарата произошел полный ответ на лечение. А уже из них 46% оставались в таком же состоянии ремиссии больше года. В этом исследовании не было группы с плацебо, все пациенты получали настоящее лечение, так что их результаты сравнивали с тем, как обычно протекает подобное заболевание. Авторы утверждают, что выживаемость была значительно выше обычного.
Над подобными “вакцинами” работают по всему миру. В России аналогичная разработка – это онколитическая вакцина «ЭнтероМикс».
Этот препарат, основанный на сочетании четырех вирусов, действует по принципу онколитической терапии. Вирусы зовутся коксаки A21, Эховирус 7, энтеровирус B75 и генетически модифицированный полиовирус PV-Russo. Последний очень напоминает западные разработки. Если посмотреть на заголовки, можно подумать, что лекарство уже готово и ждет в соседней аптеке. На самом деле «ЭнтероМикс» сейчас находится на первой фазе клинических исследований. Ученые только успели запусть набор первых желающих поучаствовать в исследовании. Работа ведется, но до доказанной эффективности лекарства еще далеко.
мРНК-вакцины
Всевозможные гомеопаты с натуропатами часто хвастаются, что у них какой-то особенный холистический личный подход к каждому пациенту. Не то что у этой ЗЛОЙ ФАРМЫ. А вот гомеопат будет два часа общаться с человеком, задавать ему кучу вопросов. И каждому пациенту он подбирает лучшее гомеопатическое средство.
Только вот потом всем выписывают дорогой сахар. Да и задаваемые вопросы к медицине порой не имеют отношения. Получается профанация, а не персонализированная медицина.
Но настоящая персонализированная медицина существует и особенно активно развивается в современной онкологии. Ведь каждый случай рака уникален. Чем является раковая клетка? Это клетка, в которой произошли определенные поломки в ДНК, приводящие к тому, что клетка чрезмерно активно делится, избегает иммунной системы и игнорирует собственные сигналы самоуничтожения. Причем комбинация мутаций, которая приводит к раку, в каждом конкретном случае может быть своя. И это может влиять как на течение болезни, так и на эффективность лечения. И даже на его правильный подбор.
Раньше такое было невозможно, но современные технологии дошли до того, что при желании мы можем взять у пациента его раковые клетки и соседние нормальные клетки, прочитать ДНК и тех, и других – и увидеть, какие именно мутации произошли в данном конкретном случае. Более того, мы можем определить уникальные антигены, свойственные данному виду рака, и использовать их для целенаправленного обучения иммунной системы.
И тут на помощь приходят мРНК-вакцины, которые являются отличной платформой для доставки генов, в том числе кодирующих раковые антигены, в клетки человека. Это нужно для создания этих самых персонализированных лекарств.
мРНК - это генетическая инструкция, говорящая клетке, какие дополнительные белки ей нужно синтезировать. Задача мРНК-вакцин в онкологии – запустить или усилить иммунную атаку на опухоль. Для этого подбирают молекулы мРНК, являющиеся инструкциями для синтеза уникальных белков опухоли — ее антигенов. И тут есть два активно развивающихся подхода.
Можно доставлять молекулы мРНК в клетки организма напрямую. А можно перейти сразу к сути. Дело в том, что обучением клеток иммунной системы занимаются особые дендритные клетки. Они захватывают антигены, обрабатывают их и выставляют на свою поверхность. Как бы показывают другим клеткам иммунной системы, например, Т-лимфоцитам, с чем им нужно бороться. Предшественников таких дендритных клеток можно выделить из крови пациента, культивировать в пробирке, снабдить нужными уникальными антигенами, например, с помощью тех же мРНК-вакцин, а потом пересадить пациенту обратно.
Идея эта не нова. Например, есть статья 1996 года, в которой проводилось исследование на грызунах.
Там ученые использовали молекулы РНК, выделенные прямо из опухолевых клеток, и «загружали» в дендритные клетки. Мышей «вакцинировали» такими клетками, а потом подсаживали им склонные к метастазам и при этом слабо иммуногенные опухоли. Но даже здесь вакцина работала: на опухоли формировался иммунный ответ, они хуже приживались и давали меньше метастаз в легкие.
Сегодня препараты на основе мРНК опухолевых антигенов разрабатываются против меланомы, глиобластомы и не только. Препараты на основе мРНК довольно неплохо переносятся пациентами. Они относительно быстро разрушаются в организме, не встраиваются в геном хозяина и способны вызывать как опосредованный антителами, так и клеточный иммунный ответ. Очень приятно и то, что производство мРНК-вакцин отличается высокой скоростью и относительно низкой стоимостью.
Вместе с подобными вакцинам часто предлагается использовать еще одно важное достижение современной онкологии. За него даже Нобелевскую премию дали. Ингибиторы чекпойнтов, или ингибиторы контрольных иммунных точек.
Дело в том, что раковые клетки коварны и учатся скрываться от иммунной системы. Раковые клетки, которые лучше всего это делают, лучше размножаются. И порой они учатся производить специальные белки, выступающие чем-то вроде стоп-слова для иммунитета. В нормальных условиях белки чек-пойнты используются в том числе для контроля аутоиммунных заболеваний и других превышений полномочий иммунитета. Ингибиторы контрольных иммунных точек – это препараты, которые лишают клетки дипломатической защиты от клеток иммунитета, позволяя лимфоцитам вести оборону на полную мощь.
Но что у нас в итоге по исследованиям таких индивидуальных противораковых подходов? Это же не одно лекарство, которое дают всем подряд. Теперь каждому человеку мы хотим давать уникальный препарат. Как это исследовать? Просто экспериментальная группа получает уникальные препараты, а контрольная группа получает стандартное лечение. Так мы оцениваем эффективность подхода всей этой технологии в целом.
Давайте посмотрим на эффективность западной вакцины mRNA-4157/V940. Это экспериментальная противораковая вакцина на основе мРНК, заключенная в липидные наночастицы. Вакцина содержит до 34 последовательностей мРНК, которые были сгенерированы с помощью автоматизированного алгоритма на основе чтения ДНК из тканей онкопациента. То есть машина изучает ДНК обычных и раковых клеток, находит отличия и предлагает, какие молекулы мРНК нужно произвести, чтобы эти отличия подчеркнуть.
В первой фазе вакцина показала безопасность и иммуногенность. Сейчас исследования этого подхода вышли на третью фазу для борьбы с меланомой. Ученые надеются, что основным результатом исследований станет увеличение безрецидивной выживаемости после терапии. Но результатов не стоит ждать раньше 2029 года.
Другая персонализированная мРНК вакцина – Autogene cevumeran. Это препарат, который разрабатывается для борьбы с раком поджелудочной железы. В России рак поджелудочной железы составляет 3,3% среди злокачественных опухолей. Но он быстро прогрессирует и имеет крайне неблагоприятный прогноз – и занимает 5-е место среди причин смертности от онкопатологии. Заболеваемость этим видом рака продолжает расти, а пятилетняя выживаемость растет очень медленно. В одном из обзоров оценили, что она выросла с 0,9% в 1975 году до 4,2% в 2011. У пациентов, которым удалось удалить опухоль, ситуация чуть лучше, но все равно пятилетняя выживаемость оценивается в 17,4%.
Именно поэтому работа над новыми подходами вроде Autogene cevumeran так важна. Принцип здесь такой же, как и с другими мРНК-вакцинами. Делается биопсия опухоли, проводится её генетический анализ, в результате которого выявляются индивидуальные опухолевые антигены. Затем производятся соответствующие м-РНК, которые вводятся пациенту.
В клиническом исследовании первой фазы Аutogene cevumeran применяли после хирургического удаления аденокарциномы протоков поджелудочной железы в составе комбинированной терапии. Вакцину создавали индивидуально для каждого пациента и включали в каждую из них до двадцати уникальных антигенов. Не радует только количество испытуемых – их было всего 16 человек. Но результаты оптимистичные – у половины пациентов вакцина вызвала мощный иммунный ответ.
Ученые посмотрели, у кого из пациентов в течение трех лет случился рецидив. К семи из восьмерых пациентов, у которых ожидаемого иммунного ответа не последовало, опухоль вернулась. Но ни у кого из восьми человек, у которых выраженный иммунный ответ был, она не вернулась. При этом различия нельзя было объяснить просто более «сильным» или «слабым» иммунитетом пациентов. Обе группы одинаково реагировали на несвязанную мРНК-вакцину против COVID-19. Возможно, тут мы как раз наглядно видим специфику индивидуальных лекарств. Сама методика может быть рабочей, но не каждое индивидуально подобранное средство одинаково эффективно для всех пациентов. Возможно, если научиться подбирать антигены еще лучше, то и эффективность лечения вырастет.
Клинические испытания этого подхода еще не окончены. И, к сожалению, есть основания полагать, что до выхода лекарства на рынок дело может не дойти. В своем отчете за третий квартал BioNTech, разрабатывающие вакцину, сообщили, что в первом промежуточном анализе исследование второй фазы перешло отметку futility, то есть бесперспективности. Это критерии, на основании которых ученые досрочно признают несостоятельность своей работы и завершают исследования, чтобы перестать зря тратить время пациентов и врачей. В то же время компания подчеркнула, что пока не планируется прекращать исследования. Новые данные должны появится ориентировочно в начале 2026 года. Конечно, хочется верить, что препарат докажет свою эффективность.
Клеточные вакцины
Напоследок расскажу о работающей вакцине от рака, которая снова не совсем вакцина. Называется она Sipuleucel-T, она же Provenge. Это первая в истории одобренная клеточная иммунотерапия для лечения рака предстательной железы. Её часто называют «вакциной от рака», но это – персонализированное лечение, созданное из иммунных клеток пациента. Препарат был разработан для пациентов с бессимптомным или минимально симптомным раком простаты.
Механизм работы Sipuleucel-T следующий: у пациента забирают белые кровяные клетки, в первую очередь дендритные клетки. Именно они умеют «обучать» иммунитет. В лаборатории эти клетки инкубируют с опухолевым антигеном и иммунным стимулятором GM-CSF, который помогает дендритным клеткам активироваться. После такой «тренировки» клетки возвращают обратно пациенту, где они запускают направленный иммунный ответ против опухоли.
Клинически Sipuleucel-T показал умеренный, но статистически значимый эффект. В сравнении с группой плацебо препарат давал пациентам около 4 дополнительных месяцев жизни. Через три года после начала лечения выживаемость составляла около 32% в группе Sipuleucel-T против 23% в контрольной группе. FDA одобрило препарат в 2010 году.
Заключение
Меня искренне поражает тот уровень детализации, с которым мы сейчас понимаем процессы, происходящие в раковых клетках. Только вдумайтесь: лишь 70 лет назад мы узнали о том, что ДНК представляет собой двойную спираль. А теперь можем вот так разбирать ее по кусочкам и собирать обратно, комбинировать гены и встраивать их в отдельные клетки. И даже анализировать ДНК отдельных раковых клеток! И ведь мы наблюдаем только начало этого большого процесса.
Многое еще предстоит понять. А то бывает, что приводишь на первый взгляд логичный биологический механизм, который должен решить проблему. А он берет и проваливается на практике.
Но со временем черных пятен в нашем понимании будет становиться все меньше. Для этого нам и нужна наука, для этого нам нужно ее хорошее финансирование. Очень важно, чтобы мы как общество понимали, что все наши вложения в науку сделают жизнь будущих поколений качественнее и длиннее.
Сколько смертей мы предотвратили с помощью обычных вакцин! Сколько спасли антибиотиками. Скольких вылечили от болезней, которые считались неизлечимыми. И я надеюсь, что через 50 лет то же самое мы сможем сказать про большинство видов рака. «Представляешь, раньше столько людей умирало, а теперь пара инъекций – и ты здоров». Я искренне желаю, чтобы это будущее наступило как можно скорее. И желаю лучшего лечения всем тем, кто, к сожалению, уже столкнулся с таким ужасным заболеванием.
Подписывайтесь на соц. сети:
Мой авторский цикл лекций
Моя настолка
Источники



Наука | Научпоп
9.5K поста83K подписчиков
Правила сообщества
Основные условия публикации
- Посты должны иметь отношение к науке, актуальным открытиям или жизни научного сообщества и содержать ссылки на авторитетный источник.
- Посты должны по возможности избегать кликбейта и броских фраз, вводящих в заблуждение.
- Научные статьи должны сопровождаться описанием исследования, доступным на популярном уровне. Слишком профессиональный материал может быть отклонён.
- Видеоматериалы должны иметь описание.
- Названия должны отражать суть исследования.
- Если пост содержит материал, оригинал которого написан или снят на иностранном языке, русская версия должна содержать все основные положения.
- Посты-ответы также должны самостоятельно (без привязки к оригинальному посту) удовлетворять всем вышеперечисленным условиям.
Не принимаются к публикации
- Точные или урезанные копии журнальных и газетных статей. Посты о последних достижениях науки должны содержать ваш разъясняющий комментарий или представлять обзоры нескольких статей.
- Юмористические посты, представляющие также точные и урезанные копии из популярных источников, цитаты сборников. Научный юмор приветствуется, но должен публиковаться большими порциями, а не набивать рейтинг единичными цитатами огромного сборника.
- Посты с вопросами околонаучного, но базового уровня, просьбы о помощи в решении задач и проведении исследований отправляются в общую ленту. По возможности модерация сообщества даст свой ответ.
Наказывается баном
- Оскорбления, выраженные лично пользователю или категории пользователей.
- Попытки использовать сообщество для рекламы.
- Фальсификация фактов.
- Многократные попытки публикации материалов, не удовлетворяющих правилам.
- Троллинг, флейм.
- Нарушение правил сайта в целом.
Окончательное решение по соответствию поста или комментария правилам принимается модерацией сообщества. Просьбы о разбане и жалобы на модерацию принимает администратор сообщества. Жалобы на администратора принимает и общество Пикабу.