Myxomycete
Как запороть первое свидание
Переехали недавно в новый дом, кошка изучает окружение. Пришел соседский кот, хотел спокойно познакомиться, но что-то пошло не так...
Прошу прощения за вертикальное видео, еле успел телефон из кармана достать.
Какие бывают типы прививок
Россию захлестнула очередная волна коронавируса, смертность бьет печальные рекорды - а большинство наших соотечественников все еще считает прививки происком дьявола, чипированием, принудительным изменением ДНК и т.п. Я решил хоть какую-то лепту внести в дело просвещения народа и перевел на русский замечательные инфографики с сайта www.immunology.org на тему того, какие типы прививок бывают и как они работают. Если Вы запутались, в чем отличие Спутника от ЭпиВакКороны - добро пожаловать, это пост как раз для Вас. Формат - "картинка - мои комментарии" - все должно быть просто для восприятия. Задавайте вопросы в комментариях, если что-то непонятно, постараюсь помочь. Поехали!
1. Живые вакцины
Их еще называют аттенуированными - эти вакцины знакомы всем нам с детства. Это прививка от кори и капельки в рот от полиомиелита. Ослабленный вирус размножается в организме и вызывает инфекцию, которая, как правило, проходит в незаметной форме, но тем не менее ведет к образованию иммунитета. В случае COVID-19 такие вакцины, насколько мне известно, пока только на стадии разработки.
2. Инактивированные вакцины
Вирусы мочат температурой или ядами, а потом вводят пациенту. Из-за чуть более низкой эффективности по сравнению с живыми вакцинами тут требуется либо адъювант (усилитель действия прививки), либо несколько доз вакцины. У нас, кстати, к эту классу относится Чумаковская вакцина от COVID-19 под названием КовиВак.
3. Белковые вакцины
Белковые вакцины относятся к группе субъединичных вакцин - здесь пациенту вводят не патоген целиком, а только его кусочек. Плюс в том, что такой подход стопудово не вызовет то самое заболевание, от которого должен защитить. Минусы тоже есть: во-первых, ответ иногда довольно слабый, и требуется несколько доз или адъювант. Во-вторых, поиск именно того самого кусочка иногда вызывает сложности - и, как мы видим на примере не самой удачной вакцины ЭпиВакКорона, работает это не всегда хорошо.
4. Векторные вакцины
Про эти уже все кому ни лень писали, т.к. к этой группе относится бедолага Спутник V. Кусок генома коронавируса вставляют внутрь вируса-носителя (в случае Спутника это два штамма аденовируса). Носитель доставляет груз в клетку, где она, используя собственные ресурсы, создает на основе куска генома коронавирусный белок-антиген, к которому вырабатываются антитела. По Спутнику вчера вышла положительная статья в Nature, так что, с учетом всех прочих данных, можно смело говорить, что это лучший вариант, доступный сейчас российскому потребителю.
5. Вакцины на основе генетического материала
Тут надо сразу оговориться, что для вакцинации человека пока применяют только РНК-вакцины (как раз Пфайзером привит Ваш покорный слуга). Это относительно новое изобретение человечества, которое, однако, показало отличные результаты. Фактически, это просто РНК, запакованная в липидную капсулу. Эта РНК кодирует определенный вирусный белок/фрагмент белка. РНК попадает в клетку, и там запускается синтез соответствующего вирусного белка. Ну а дальше на него вырабатываются антитела - все как всегда.
Надеюсь, мне удалось немного структурировать у читателя информацию по вакцинам. Прививайтесь, друзья! Не дадим этому мерзкому вирусу забрать еще больше жизней.
Миша Окунь
Как фундаментальная наука меняет мир
Добрый день, дорогие читатели!
Я частенько сталкиваюсь с тем, что обывателям, далеким от науки, не совсем понятна роль фундаментальных исследований в нашем мире. Фундаментальную науку я здесь специально противопоставляю прикладной. Ну, вы поняли - когда ученые в лаборатории Danone ломают головы над тем, как продлить срок хранения йогурта - это прикладная наука. А фундаментальная - эта та, которая не имеет целью принести непосредственную ежеминутную пользу. Разделение фиговое и местами трещит по швам, но для этого поста подойдет. И речь сейчас не о каких-нибудь "крутых" исследованиях, типа чуваков в ЦЕРНе, которые вот-вот изобретут телепорт (шутка) или биологах, которые буквально у нас на глазах улучшают прогноз больных раком. Нет - речь о тех самых условных "Дуремарах", которые сидят себе в пыльном кабинете и изучают что-то только им одним интересное, типа строения ножки жука (да простят меня энтомологи). Казалось бы - ну сидит себе человек, занимается любимым делом - но миру он вряд ли этим как-то поможет...
Но реальность, как всегда, гораздо интереснее. Порой в самых неожиданных случаях из сугубо фундаментальных исследований выходит такая практическая польза, что даже сложно себе представить мир без этого изобретения. В этом посте я приведу три примера такого рода из родной мне биологии. Поехали!
Горячие источники и ПЦР
Радужная лужица в Йеллоустоуне поменяла мир. Источник - Википедия
Еще в начале второй половины 20го века биологам стало понятно, что ДНК надо чертовски срочно исследовать, потому что это просто дохрена важная молекула. Одиозный гений Кэри Муллис придумал ПЦР - метод, позволяющий многократно копировать целевой участок цепи ДНК, увеличивая его концентрацию с виртуально даже пары копий до триллионов - количества, с которым можно нормально работать. Кто совсем не помнит, о чем речь - добро пожаловать в один из моих прошлых постов. Так вот, все круто, метод есть, но остался один нюанс - в ходе реакции образец многкратно (около 30 раз) нагревается почти до кипения, и при этом ключевой фермент, используемый в ПЦР - полимераза - тупо сваривается. После каждого такого нагрева несчастному лаборанту нужно было вручную добавлять полимеразу заново - а это мало того что куча времени, так еще и деньги, потому что фермент это дорогой (особенно в те времена). И вот тут пригодились те самые фундаментальщики, которые всю свою жизнь сидели на берегу горячих источников в Йеллоустоунском заповеднике и собирали там цветастую жижу... А в жиже этой живут термофильные (т.е. любящие высокие температуры) микроорганизмы, в том числе некая бактерия Thermus aquaticus. И ведь не лень было этим ученым копаться в вонючей грязи, потом выращивать культуры в лаборатории, разбивать на штаммы... Казалось бы - ну зачем? А некто Alice Chien взяла да и выделила из штамма YT-1 полимеразу, которая мало того что не варится при 95 градусах, так и работать может нормально только при 72х! Не будет преувеличением сказать, что этот последний кирпичик окончательно вознес ПЦР в короли молекулярной биологии, а оттуда и до диагностики в медицине недалеко. Готов поспорить, что большинство из вас хоть раз в жизни сдавали пробу на ПЦР - ну а с приходом нашего любомого друга SARS-CoV-2 это вообще стало актуально как никогда. ПЦР революционировала научный мир и как никакой другой метод способствовала стремительному накоплению знаний во всех биологических областях. Вот тебе и лужица с микробами в парке...
Мечехвосты и эндотоксины
Несчастные мечехвосты спасают миллионы жизней. Источник
Определение бактерий в производстве продуктов питания и особенно в лекарствах - очень важный этап производственного процесса. Нам, обывателям, это не заметно - пришел в аптеку и купил. Но за каждым (нормальным) лекарством стоят тысячи часов тестов на чистоту. Бактерии имеют нахальное свойство вырабатывать т.н. эндотоксины - вещества, от которых всем вокруг, кроме этих бактерий, становится очень плохо. А учитывая, что большинство рекомбинантных лекарств (инсулин, например) производят бактерии - очень важно убедиться, что в финальном продукте нет коварных примесей, от которых пациенту станет отнюдь не лучше! Да и в еде или напитке желательно без них обойтись. Как проверять? Берешь кролика, колешь ему исследуемый препарат, а потом смотришь не сдох ли измеряешь ему температуру и делаешь выводы. Долго, дорого и неточно... Фундаментальщики, спасайте! Пока одни ученые самозабвенно копались в термальных источниках, других тянуло в морские пучины. Вы вот слышали о мечехвостах? Это такие безобидные членистоногие, называемые Limulus polyphemus, пережитки прошлой эпохи, мирно себе плавающие в прибрежных водах. Я до сих пор не могу понять, что заставило Фреда Бэнга в 1953м проверить, как голубая кровь мечехвостов реагирует на наличие бактерий. Может, его необычный цвет крови привлек... так или иначе, выяснилось, что их кровь при наличии даже мельчайших бактериальных примесей (даже кусков мертвых бактерий) превращается в гель, что позволяет быстро и легко определять наличие микробов или их производных в чем угодно - даже на стенках МКС. В итоге в 1977м FDA (такой очень важный американский контролирующий орган) предписала проверять с помощью экстракта из крови мечехвостов вообще все препараты, а также продукты, контактирующие с кровью человека. Тест этот называется LAL (Limulus amebocyte lysate) и применяется и по сей день, в том числе при разработке вакцин от коронавируса. Крабов жалко, многие гибнут в процессе сборки крови, поэтому тест пытаются где возможно заменить на более этичные (и более дорогие) альтернативы.
Медузы и молекулярная биология
Медуза даже представить себе не может, что у нее внутри. Источник
Некоторые биологи очень любят смотреть в микроскоп. С появлением более крутых методов микроскопии, а также развитием клеточной биологии ученым открылись удивительные процессы, происходящие на микроуровне наших тел. Но в у любого метода есть свой предел возможностей. Например, я хочу увидеть, как какой-нибудь конкретный белок двигается по клетке. А там этих белков тысячи... Это как искать одного человека в толпе на стадионе. Надо было что-то придумывать... Помните, как зубы девушки, белая футболка и ваша перхоть светятся под ультрафиолетовой лампой в клубе? Вот бы также с нашим белком сделать, подумали ученые и придумали флуоресцентную микроскопию. Берем флуорофор - это такая молекула, которая светится при определенных условиях - и пришпиливаем его к нашему белку, прям как отражатель к велику. Или к клетке - да и вообще к чему угодно, что надо увидеть. И вуаля - наш объект изучения светится как семафор в ночи. Но вот загвоздка: поиск хороших флуорофоров - еще та задачка. То они жутко дорогие, то для их свечения нужны безумные танцы с бубном, то само наличие флуорофора в клетке мигом убивает ее нахрен. И тут нам на помощь приходят плавающие в океане желешки под названием Aequorea victoria. Троица ученых - Мартин Чалфи, Осаму Шимомура и Роджер Тсиен - решили докопаться до ответа на вопрос, почему эти медузы так приколько мигают зеленым, и в семидесятых выделили из них - потребовалось около 10000 особей - белок GFP (Green Fluorescent Protein). Этот дешевый и очень эффективный способ окраски полсужил мощным толчком в развитии техники флуоресцентной микроскопии, без которой сегодня сложно представить обычную цитологическую лабораторию. Без преувеличения можно сказать, что с помощью этой технологии сегодня проводится подавляющее большинство исследований в области клеточной физиологии. Кстати, не обошла эта волна и фармакологию - все разрабатываемые препараты и вещества, являющиеся кандидатами в лекарства, тестируются на клеточных культурах - и визуализируются, как правило, все той же флуоресцентной микроскопией. Более того, обнаруженный в медузе механизм передачи флуоресцентной энергии с одного белка на другой (FRET) удалось перенести в лабораторию, и сейчас он активно применяется в диагностической ПЦР - об этом в моем прошлом посте. Ну а трём ребятам дали Нобелевку в 2008 - спасибо, медузки!
Меня тянет рассказать еще про много чего - креветок и генную инженерию, пищеварительные ферменты и стиральный порошок... Но, надеюсь, посыл ясен: без фундаментальных исследований у пирамиды человеческих знаний просто нет основания. Причем мы не можем заранее предугадать, в какой области надо копать - важно может быть все. И пускай только малая толика из исследованного когда-то понадобится - пренебрегать нельзя ничем. Учитесь и исследуйте, друзья!
Мутантная GFP-свинка не понимает, почему ты не светишься от счастья
Что такое CRISPR?
Те из вас, кто старается следить за достижениями в области современной биологии, хотя бы раз наверняка сталкивались с упоминанием загадочной технологии CRISPR, которая вроде как революционировала поле боя молекулярных генетиков. Предполагаю, что даже многие биологи плохо себе представляют, как эта штука работает и какие возможности дает, так что решил запилить пост на эту тему. Сразу скажу, что для понимания содержания статьи потребуется как минимум знать, что такое ДНК. Если надо освежить знания – добро пожаловать в мой прошлый пост.
Итак, встречайте:
CRISPR - Clustered Regularly Interspaced Short Palindromic Repeats (регулярно расположенные группами короткие палиндромные повторы) – это вообще такие участки генома бактерий и архей, отвечающие за любопытную систему защиты от вирусов. Еще в далеком 2013м ученые смогли заставить эту систему работать в искусственно созданных условиях, заставляя ее резать ДНК не в бактериях, а вполне себе в эукариотических клетках. С тех пор много воды утекло, элементы этой системы подпилили до совершенства и коммерциализировали все кому не лень. Но как же оно все работает в лаборатории и помогает ученым? Давайте разбираться.
Одна из задач, которую решают современные молекулярные генетики – зачем нужен какой-то ген. Прочтение генома в наше время – довольно простой процесс, но он даст нам тупо последовательность букв, а не понимание того, какой ген за что отвечает. Классический способ узнать, зачем нужен какой-то ген – вырубить его и посмотреть, что будет. Научным языком это называется «нокаутировать» ген, а полученный организм – «нокаут» по такому-то гену. Далее можно исследовать, что же не так с несчастным животным/растением, и делать выводы о функциях вырубленного гена.
Казалось бы, нормальная мышка, но на самом деле это нокаут по гену RAG1, и у этой мышки нет иммунитета.
И вот очень классно было бы иметь способ, позволяющий просто резать ДНК в ровно нужном тебе месте, вырубая именно тот ген, который надо... В принципе, до прихода CRISPR такие методы существовали (см. TALEN, например), но, как правило, они все были довольно трудоемкими в исполнении. CRISPR же - сравнительно простая технология, применение которой легко поставить на поток. Что же конкретно происходит при ее применении? Чтобы разобраться, давайте сначала введем несколько важных терминов, без которых никак.
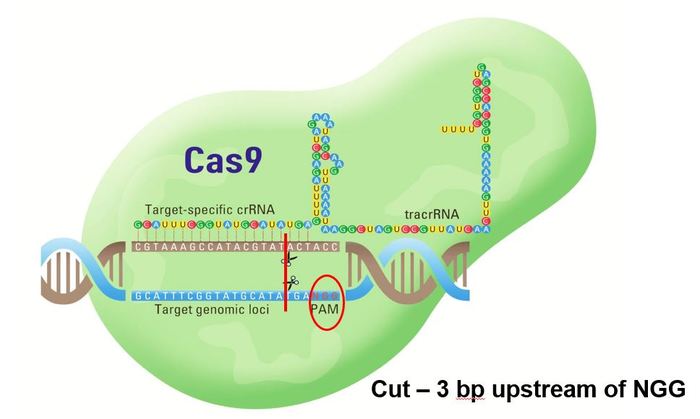
Сas9 – бактериальный белок, способный вносить двунитевые разрывы в молекулу ДНК (вы же помните, что там две нити, да?).
Guide RNA, или gRNA – специальная молекула РНК, которая служит как система наведения – она заставляет белок Cas9 резать там, где надо. Напомню, что РНК химически очень похожа на ДНК, но так исторически сложилось, что РНК выполняет в клетке иные функции, чем ДНК.
CRISPR RNA, или crRNA – часть gRNA, отвечающая непосредственно за наведение Cas9 на цель.
Tracer RNA, или tracrRNA – вторая часть gRNA, она отвечает за связывание с белком Cas9. В природе эта и предыдущая штуковина – две отдельные молекулы, но в лабораторных опытах, как правило, используют химерную молекулу, в которой эти половинки просто сшиты друг с другом.
Вот теперь можно переходить к практике. Допустим, ученым надо вырубить ген А в культуре клеток. Культура клеток, кстати – это такая каша из клеток, как правило, одного типа, которая просто растет в специальной емкости в лаборатории. Ученые часто с ними работают, чтобы не париться с настоящими животными и не мучить людей. Так вот, ученым известна последовательность ДНК того самого гена А в этих клетках, и они решают использовать метод CRISPR, чтобы сделать грязное дело. Для этого берется (заказывается у поставщика или синтезируется самостоятельно) молекула gRNA, причем молекула эта подбирается таким образом, чтобы ее кусок – crRNA – был комплементарен тому участку гена А, который надо разрезать. К ней подмешивается белок Cas9 – эдакие безумные ножницы, которые очень любят резать ДНК. Однако сами они резать как попало не могут – им надо показать, где резать – именно это и делает gRNA. Эту смесь из gRNA и Сas9 засовывают внутрь клеток (тут есть разные способы, это отдельная история), где она и приступает к работе. Вторая половина gRNA называется tracrRNA, и за нее белок Cas9 цепляется к gRNA. Благодаря crRNA дружная парочка gRNA+Cas9 садится на нужный участок ДНК клетки и режет обе цепи ДНК. Причем не где-нибудь, а в строго определенном месте – между шестой и седьмой буквой того участка генома, который был комплементарен crRNA. Единственное условие тут – первые три буквы этого участка должны быть NGG, где N – это вообще любая буква. Не хочу излишне пудрить вам мозги, но эти волшебные важные три буквы называются PAM site (Protospacer Adjacent Motif).
Схема работы комплекса CRISPR-Cas9. Зеленая блямба – белок Cas9 – вместе с цветастой молекулой gRNA, состоящей из crRNA и tracrRNA, сел на геномную ДНК в клетке. Красной линией отмечено, где именно Cas9 разрежет двунитевую ДНК – 3 буквы «вверх по течению» от триплета NGG.
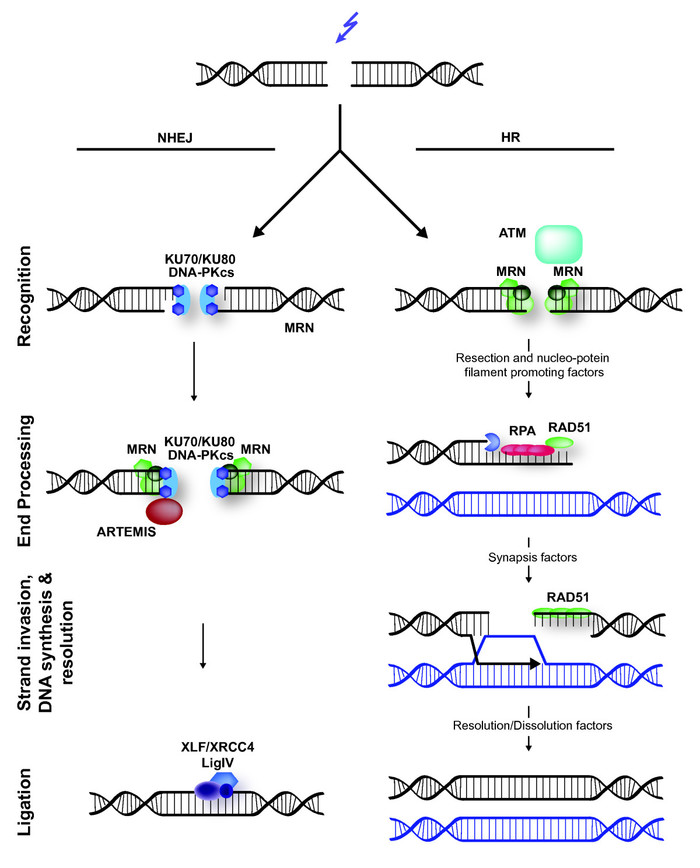
И вот тут начинается самое интересное. Заметьте, система CRISPR просто вносит разрез, она больше ничего не умеет! Достаточно ли этого, чтобы вырубить ген в клетке? Никак нет. За миллионы лет эволюции живые системы научились беречь ценную ДНК и исправлять в ней всякого рода разрывы, химические поражения и прочие гадости. Занимается этим специальная клеточная контора под названием система репарации ДНК. Как только она замечает, что имеет место двунитевой разрыв ДНК, на место аварии сразу рекрутируются разные белковые комплексы, которые пытаются исправить ситуацию, причем каждый по-своему. Доходит до того, что они реально конкурируют друг с другом за право починить ДНК, и в итоге существует несколько вариантов развития событий.
Вариант 1. Процесс идет по пути негомологичного слияния концов – Non-Homology End Joining (NHEJ). Чертова куча белков прилетает на место разрыва, и работает прям как ваш сантехник – одни отрезают чуть-чуть оборванные концы (не всегда, правда), другие достраивают концы как надо, третьи сшивают место обрыва. Удобно, быстро – но не всегда точно!! Во время достраивания концов иногда в последовательности оказываются буквы, которых там изначально не было, причем их количество тоже может варьировать. Извини, начальник, так получилось... Ну а если все сделали как надо – наш комплекс CRISPR-Cas9 никуда не делся, и он опять порежет это место! И так до тех пор, пока рьяные белки-помощники не изменят место разрыва до такой степени, что Cas9 больше не сможет на него сесть. Ну или Cas9 самовыпилится, устав хреначить ДНК.
Вариант 2. Процесс идет по пути гомологичной репарации – Homology Directed Repair (HDR). Тут все еще сложнее: вместо того, чтобы тупо сшить два куска ДНК, попутно вставив пару сомнительных букв, эти белки решают «заглянуть в инструкцию» - в данном случае, во вторую копию этого гена в сестринской хромосоме! Вы ведь помните, что у большинства организмов (включая нас с вами) в каждой клетке содержится две (а то и больше) копии ДНК? На всякий ген есть его гомологичная «сестричка», которая более или менее на него похожа. В случае HDR путем хитрых манипуляций белки используют сестринскую копию гена, чтобы правильно восстановить место разрыва. Этот метод более надежный, чем NHEJ, и дает ученым одно важное преимущество, о котором мы поговорим чуть позже. Напомню, что если системе репарации удалось восстановить исходную последовательность порванной цепи, то ее, беднягу, опять режет Cas9, и все начинается с начала.
Схема путей репарации ДНК. Слева – путь NHEJ, быстрый и неточный. Справа – HDR, использующий гомологичную хромосому в качестве инструкции.
Итак, если мне хочется просто нокаутировать ген в моем объекте исследования, мне достаточно надеяться, что клетка после обработки CRISPR-Cas9 запустит первый вариант репарации (NHEJ), и в итоге часть клеток получит мутации, которые вырубят нужный мне ген. Профит, дело сделано. Но зачем я тогда упоминал про второй вариант репарации, спросите вы? Давайте еще раз на него посмотрим. Белки используют гомологичную копию гена, чтобы исправить повреждение. А что если...(с этого начинаются все безумные идеи ученых)...что если этим белкам под видом гомологичной копии подсунуть кусок ДНК, который мы сами создали, который содержит нужные нам изменения в гене? Тогда они вставят информацию с этого куска в геном в твердой уверенности, что сделали все как надо... Образно говоря, мы слегка подправили им инструкции. И действительно, так и происходит! Такая технология позволяет нам не просто вносить заранее непредугадываемые изменения в ДНК, но и абсолютно точно изменять нужные нам ее участки. Обратите внимание, что CRISPR в этом случае тупо ломает ДНК там где надо, чтобы тем самым вызвать «сантехников», а всю реальную работу делают уже они. С точки зрения лабораторного эксперимента все просто: в этом случае вместе с gRNA и белком Cas9 мы также вводим в клетку кусок ДНК, несущий нужный нам код – он называется донором. В идеальном варианте информация донора в неизмененом виде встроится в целевой геном, добавляя клеткам или организму нужные нам генетические особенности.
Итак, суммируем: для простого нокаута нам достаточно полить клетки/организмы смесью из gRNA и Cas9, чтобы сами клетки при попытке исправить устроенные Cas9 разрушения с помощью механизма NHEJ внесли в ДНК случайные мутации, вырубающие ген. Для точной же модификации ДНК мы также добавим в нашу взрывную смесь донорную последовательность, которую клетки благополучно используют в процессе HDR, чтобы «поправить» свою ДНК (а на деле внести в нее необходимые нам изменения).
Разумеется, такие эксперименты требуют нехилых умственных и временных затрат: надо заранее продумать последовательность gRNA, чтобы она вела Cas9 к нужному месту в геноме, а не куда-нибудь еще. Если мы идем по пути HDR, то также надо продумать последовательность донора. Кроме того, надо спланировать, как и в каком виде мы будем доставлять все это в клетки – тут есть разные варианты в зависимости от кучи факторов (тип клеток, размер вставки и т.п.). Наконец, последняя часть эксперимента самая нудная – нам надо отсортировать клетки, в которых ничего не поменялось (клетки дикого типа), от тех, где мутация произошла! Тут у ученых тоже имеется целый арсенал методов, от простых на основе ПЦР, типа GCD (Genomic Cleavage Detection), до полногеномного секвенирования на монстроподобных агрегатах.
Надеюсь, мне удалось простым языком объяснить, что же такое CRISPR, и как его применяют! В качестве бонуса фотка меня пару лет назад, когда мне удалось лично познакомиться с применением технологии CRISPR.
Эти зеленые клеточки на экране микроскопа еще вчера были синими, но потом пришел автор и с помощью протокола HDR внедрил однонуклеотидную замену в ген BFP, превратив его в GFP.
Спасибо, что прочитали! До встречи в новых постах!
ПЦР: эпизод II – возвращение полимеразы
Дорогой читатель, с возвращением! В моем первом посте мы основательно разобрались с тем, что такое ПЦР, и как она работает. Узнали, что в клетках есть двойная спираль ДНК, а полимераза при делении клетки ее «копирует», достраивая вторую цепь на основе первой. Помогают ей в этом праймеры – небольшие кусочки однонитевой ДНК. В живых системах все это называется репликацией. ПЦР, по сути, это многократная репликация в пробирке – эдакий безумный ксерокс, штампующий нужный кусок ДНК в геометрической прогрессии. Этот метод взяли на вооружение врачи, чтобы находить малейшие следы ДНК патогенов в наших с вами телах (кстати, у животных тоже, разумеется). Главное – подобрать хорошую пару праймеров – и готова тест-система на какое-либо заболевание. Если реакция прошла – значит, патоген изначально присутствовал у пациента. Мы остановились на том, что осталось понять, прошла ли реакция, или нет. Как это узнать? Давайте разбираться.
В случае, если реакция прошла успешно, в нашей пробирочке окажется очень много ДНК. Если же реакция не прошла, ДНК будет на несколько порядков меньше. Как определить наличие ДНК? Ученые придумали много методов.
Один из самых простых – фотометрия. Суть метода в том, что многие вещества способны поглощать свет определенной длины волны. Например, кола в прозрачной бутылке на просвет покажется нам темно-коричневой, потому что она поглощает практически все волны видимого света. ДНК тоже поглощает свет, только в ультрафиолетовом диапазоне (около 260 нм). Чем больше ДНК – тем меньше ультрафиолета пройдет сквозь пробирку. Итак, берем пробирку после ПЦР, ставим в фотометр и меряем оптическую плотность. Современные приборы автоматически пересчитывают ее в концентрацию ДНК.
NanoDrop - один из самых популярных спектрофотометров. Для измерения хватит 2 микролитров - это меньше, чем слезка вашего хомячка
Метод очень простой, но неточный – результат зависит от множества факторов, типа загрязнения пробы. Кроме того, так мы узнаем, что ДНК есть, но не узнаем, какая именно. Это важно – ведь полимеразе, в общем-то, все равно, что реплицировать. Если мы ошиблись с праймерами, намудрили с температурным протоколом во время реакции или просто плюнули в пробирку, то на выходе получим не наш целевой фрагмент ДНК, а что-то другое, или, того хуже, смесь разных фрагментов. Такая неудачная ПЦР называется неспецифичной – адский кошмар для любого, кто работает в молекулярной лаборатории! Надо было что-то придумать, чтобы различать специфический фрагмент от мусора... Тут на помощь пришел другой аналитический метод –
Флуорометрия – тут все слегка сложнее. Есть такие вещества – флуорофоры. Они имеют любопытное свойство – если на них посветить (возбудить) светом определенной длины волны, они в ответ светятся (излучают), но другим светом. Светишь, например, на медузий белок GFP синим, а он тебе в ответ зеленым! Что еще круче, некоторые флуорофоры проявляют свои волшебные свойства только в том случае, если они связались с молекулой ДНК. Их называют умным термином «интеркалирующие красители». Классический пример, вызывающий икоту у любого молекулярщика – вещество под названием бромистый этидий (канцерогенное, кстати). Связываясь с ДНК, эта штука начинается светиться оранжевым, если на нее светить ультрафиолетом (кстати, зеленый свет тоже работает). Итак, поехали: бахаем в пробирку после ПЦР бромистого этидия, светим ультрафиолетом, и считываем ответное оранжевое свечение. Метод на несколько порядков более точный, чем фотометрия, но мы ведь так и не решили проблему с возможной неспецификой... Надо как-то отделить нужные фрагменты ДНК от ненужных. Это умеет делать другой метод в молекулярной биологии –
Электрофорез. Возможно, вы сталкивались с этим словом в медицине, когда вас нежно били током в разные места, но тут несколько другой случай. На сегодняшний день одним из самых распространенных методов в лабораториях сегодня является гелевый электрофорез, его и разберем. Рецепт прост: готовим (или покупаем готовый, если мы буржуи) из агарозы и воды холодец – реально как мамин холодец, только без мяса! Его называют просто гелем. В геле делаем луночки и заливаем в них наши образцы после ПЦР. Все это дело помещаем в специальную ванночку, в которой врубаем ток. ДНК в водном растворе имеет отрицательный заряд и под действием электрического поля начинает двигаться от минуса (катода) к плюсу (аноду). Но прикол в том, что через гель ей приходится протискиваться, причем длинным молекулам это дается сложнее, чем коротким. В итоге, если в пробе присутствуют молекулы ДНК разной длины, они сбиваются в стайки, бегущие с разной скоростью. В какой-то момент мы вырубаем ток, добавляем в гель интеркалирующий краситель (а иногда он заранее подмешан в гель), и смотрим на наше блюдо под нужной длиной волны.
Слева - форезная камера, в которой плавает гель, погруженный в буферный раствор. На геле видны лунки с образцами (их подкрашивают синим красителем)
Справа - фото геля после электрофореза. ДНК бежала сверху вниз. Первая дорожка - маркер, в остальных пробы. Светящиеся полоски - те самые стайки из фрагментов ДНК одного размера. Фото сделал я :-)
Если параллельно с пробой в одной из лунок прогнать смесь из молекул ДНК с заранее известной длиной (ее еще называют «маркер», или англ. DNA ladder), то, глядя на результат, мы сможем примерно подсчитать длину получившихся в ходе ПЦР фрагментов. А так как мы заранее знали, какой длины должен быть наш целевой фрагмент, то можем легко понять, имела ли место в данном случае неспецифическая реакция, или нет. Предвосхищая вопросы, замечу, что, если неспецифический продукт ПЦР имеет волею судеб ту же длину, что и целевой, то электрофорез, разумеется, не даст нам их различить.
Но все эти описанные выше методы требуют от нас делать что-то с пробой уже после того, как ПЦР прошла. Такой подход за это еще называют «ПЦР по конечной точке» (англ. End-point PCR). Но что если интеркалирующий краситель добавить прямо в ПЦР-смесь, и проверять, как он светится, после каждого цикла? Поздравляю, вы только что изобрели
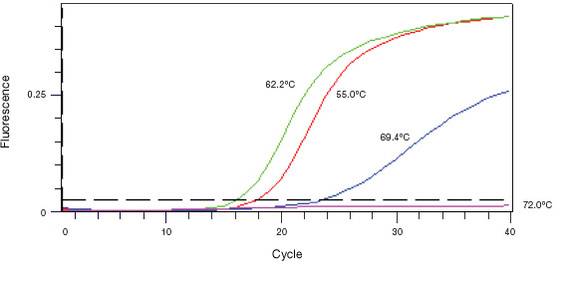
ПЦР в реальном времени. Атлант современной молекулярной биологии, этот метод дал ученым столько разных возможностей, что на описание всех их не хватит десятков постов. Суть проста: цикл за циклом количество наработанной ДНК увеличивается геометрически. С ДНК при этом связывается флуорофор-интеркалятор. Чем больше ДНК, тем ярче светится наша пробирочка. В конце каждого цикла мы детектируем ее свечение и строим график прироста флуоресценции – он называется кривой амплификации.
Кривая амплификации в qPCR. По горизонтали - циклы ПЦР; по вертикали - интенсивность свечения. Три кривые - три независимых образца. Автор фото явно указывает, что три образца прогнали при разной температуре отжига праймеров, и 62,2 градуса - самый лучший вариант, так как зеленая кривая начинает расти раньше, чем остальные.
Что нам это дало? Во-первых, теперь прямо в ходе реакции становится понятно, идет наша реакция, или нет. Не надо ждать конца реакции, грызя ногти от нетерпения, а потом еще ставить электрофорез на почти час. Во-вторых, если мы добавим в реакцию стандарты – пробы, где количество молекул ДНК известно заранее – мы сможем, сравнивая кривые амплификаций стандартов и нашего образца, путем нехитрых вычислений узнать, сколько копий ДНК изначально было в нашей пробе! Например, узнать вирусную нагрузку у носителя ВИЧ. Кстати, такая ПЦР будет называться количественной (англ. quantitative PCR, qPCR). Можно стандарты не добавлять, но сравнивать количество ДНК одного гена и другого – такое тоже часто бывает полезно.
В этом месте искушенный читатель заметит подвох – мы же выше выяснили, что решение с интеркалирующим красителем не избавляет нас от проблемы с детекцией неспецифики. Бромистому этидию, как вы понимаете, все равно, с чем связываться. Ведь отчасти для этого и ставят агарозный электрофорез – выявить ДНК нужного размера как светлую полоску на геле. Кроме того, используя интеркалятор, можно амплифицировать только один кусочек ДНК на пробирку – а что делать, если хочется больше? Но ученые и тут пошли еще дальше и модифицировали технологию ПЦР в реальном времени. Вместо добавления интеркалятора эти колдуны придумали детекцию прироста ДНК с помощью зондов.
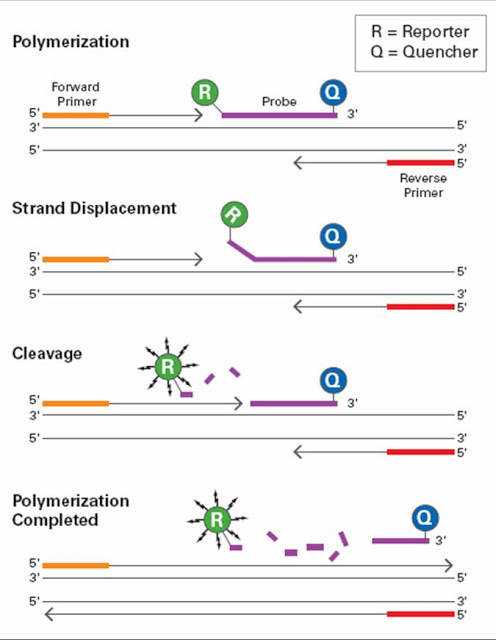
Вот тут начинаются прям суровые дебри. Читатель, одумайся, еще не поздно закрыть эту вкладку и убежать смотреть посты с котиками! Волшебство в том, что теперь вместе с праймерами, специфичными к определенному участку ДНК, в реакцию вместо интеркалятора добавляется зонд – по сути тоже праймер, кусочек однонитевой ДНК, но на нем висят две молекулы разных флуорофоров – на разных концах зонда. Назовем их молекулы А и В. Зачем это все? Если мы в попытке возбудить молекулу А посветим на нашу смесь нужным светом, молекула А возбудится и начнет светить в ответ, но... Ее свет будет поглощен молекулой В, поскольку В возбуждается именно тем светом, который испускает А! Такие хитрые отношения называются «флуоресцентный резонансный перенос энергии» (англ. FRET – Fluorescence Resonance Energy Transfer). В итоге В светит в ответ совсем другим светом, нежели А, в то время как свет А вообще не регистрируется. Мы, улавливая этот свет, знаем точно, что молекулы А и В находятся рядом друг с другом, иначе FRET бы не работал. Ну и что, скажете вы? А хитрость метода в том, что полимераза при достраивании цепи ДНК как бронепоезд сносит все, что сидит у нее на пути – а наш зонд, как Анна Каренина, лежит именно там... Полимераза расщепляет зонд, и молекулы флуорофоров А и В разлетаются в разные стороны. Теперь В не мешает А светиться в свое удовольствие, а мы детектируем свет и А, и В. Чем больше света от А (его называют репортером, а В - гасителем), тем больше специфического продукта у нас получилось на данный момент – ведь зонд изначально сел на ДНК в строго определенном месте!
Схема работы зондов при qPCR.
1) Праймеры и зонд садятся на целевой участок ДНК
2) Полимераза начинает достраивать вторую цепь, при этом сталкивая зонд с первой цепи
3) Полимераза в итоге разрушает молекулу зонда
4) Полимераза достроила цепь до конца. Репортер (Reporter) радостно светится, а гаситель (Quencher) ему не может помешать.
На выходе мы имеем ту же самую кривую амплификации, только теперь она отражает прирост только целевого продукта, а не чего попало. Но и стоить такая ПЦР из-за зондов будет подороже, чем обычный вариант с интеркалирующим красителем... Зато теперь можно добавить прямо в одну пробирку праймеры и зонды для нескольких участков ДНК – например, для нескольких генов. Осталось использовать в зондах разные красители, чтобы они своим свечением не мешали друг другу – и вуаля, мы можем детектировать прирост концентрации двух и более участков ДНК одновременно! Такая ПЦР называется мультиплексной (англ. multiplex PCR). Представьте себе, теперь можно за одну реакцию найти у вас не только ВИЧ, но и гепатит, сифилис и микоплазму! Раньше для этого пришлось бы для каждой инфекции ставить отдельную реакцию – а это время и деньги. Вот счастье-то!
Хоть ПЦР в реальном времени и является продвинутой версией стандартной ПЦР, но на деле они не особо конкурируют друг с другом. В простых случаях, когда надо всего лишь наработать какой-либо фрагмент ДНК для последующей работы с ним, обычной ПЦР хватает. Такая ПЦР дешевле и проще. А вот ПЦР в реальном времени используют как самостоятельное приложение – для оценки концентрации ДНК, генотипирования, выявления уровней экспрессии генов, в медицине, и т.д. Этот метод закономерно дороже обычной ПЦР, требует специального оборудования – real-time PCR cycler. По сути, этот тот же термоциклер из прошлого поста, но теперь с лампочкой, системой светофильтров и камерой. Кроме того, к нему полагается программное обеспечение для анализа данных.
Вот такая штука нужна для проведения ПЦР в реальном времени. Стоит как однушка в Москве.
Выражаю свое глубочайшее уважение всем тем, кто выжил до этого момента! Надеюсь, моя история не обеспечит вам головную боль на остаток дня. Я рад, если вы открыли для себя что-то новое в увлекательном мире молекулярной биологии! В планах у меня пост о том, как работает технология геномного редактирования CRISPR, о которой многие наверняка слышали. До встречи!
Что такое ПЦР, и с чем её едят
2020 год уже преподнес нам немало сюрпризов, и среди них пандемия COVID-19. Из всех труб кричат про анализы, тесты, и всюду можно услышать непонятную многим аббревиатуру - ПЦР. Полагаю, что большинство людей смутно себе представляет, что это такое, и надеюсь, что некоторым хотелось бы узнать. А я, как человек, имеющий к ПЦР непосредственное отношение, попробую объяснить максимально простым языком.
Итак, ПЦР - полимеразная цепная реакция. Чтобы объяснить, что там делает полимераза (и что это вообще), откуда цепь, и что вообще происходит, сначала надо вспомнить азы молекулярной биологии.
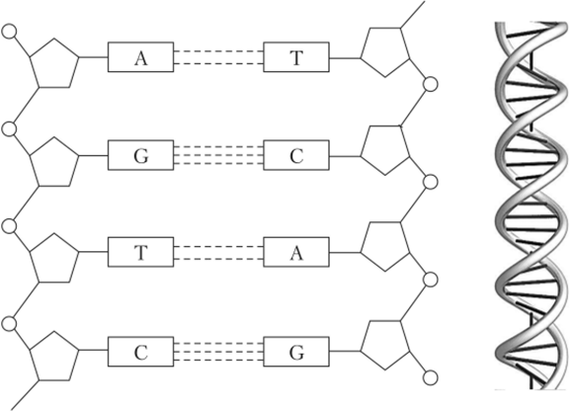
ДНК - дезоксирибонуклеиновая кислота. Это длинная (реально длинная! Пара метров!!) молекула, содержащаяся в почти каждой клетке всего живого на земле. В вирусах, кстати, тоже, хоть они и не имеют клеточного строения. На этой молекуле аки на дискете закодированы все белки, которые клетка способна производить, а также еще много чего, регулирующего работу клетки. Но если компы используют двоичный код, представляя информацию в виде кучи 0 и 1, то в ДНК информация закодирована последовательностью 4 букв - нуклеотидов. Эти 4 буквы - A, T, G и С - обозначают химические вещества аденин, гуанин, цитозин и тимин. Эти вещества тупо стоят длинной цепочкой, крепко сшитые химическими связями. Прикол в том, что ДНК состоит из двух таких цепочек, причем вторая является зеркальной копией первой (это называется умным термином "обратная комплементарность"). Как так вышло? Дело в том, что помимо сильных связей с соседями по цепи, нуклеотиды умеют образовывать еще и относительно слабые водородные связи, причем А и Т всегда будут иметь две связи, а G и С - три. Таким образом, напротив А в одной цепи всегда будет стоять Т в другой, и та же фигня с G и С.
Легко понять, что такие цепи, по сути, несут одну и ту же информацию. А так как двойная спираль ДНК значительно более устойчива к воздействию извне, то в ходе эволюции на заре истории Земли цепи решили подружиться и жить вместе. Тем более, что такая дружба дала им одно очень важное преимущество.
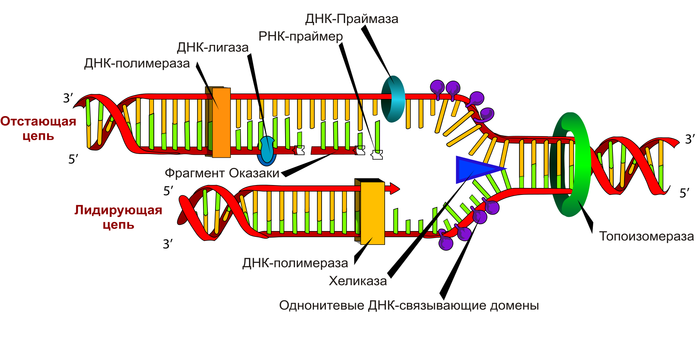
Репликация ДНК. Рано или поздно клетке надо будет поделиться, обеспечив рост организма или размножение. При этом всю эту хитро упакованную многометровую махину ДНК надо аккуратно скопипастить так, чтобы две дочерние клетки получили максимально точную копию оригинала. Вот тут-то и пригодилась двойная спираль - специальные белки в нужный момент расцепляют цепи, и на основании каждой цепи достраивается ее комплементарная копия. Отвечает за это фермент под названием полимераза. Она ползет по старой одиночной цепи ДНК и вставляет в новую цепь буквы, комплементарные старой. Видит А - вставляет Т, видит G - C, ну вы поняли. Чтобы полимераза могла сесть на одиночную цепь ДНК и начать свое дело, ей нужна затравка - это уже готовый маленький кусочек второй цепи, сидящий на первой. Его еще называют праймер. В клетках его делает специальный фермент праймаза, да и вообще там на самом деле жесть все как сложно, но об этом в другой раз.
Адская схема репликации. Все, что надо понять - была одна двойная спираль, а стали две, и помогли им в этом, помимо все прочего, праймеры и полимераза.
Так или иначе, в итоге вся ДНК в клетке удваивается, и вот теперь клетка может спокойно делиться. Прочитали до сюда? Отлично! Вот теперь можем переходить непосредственно к
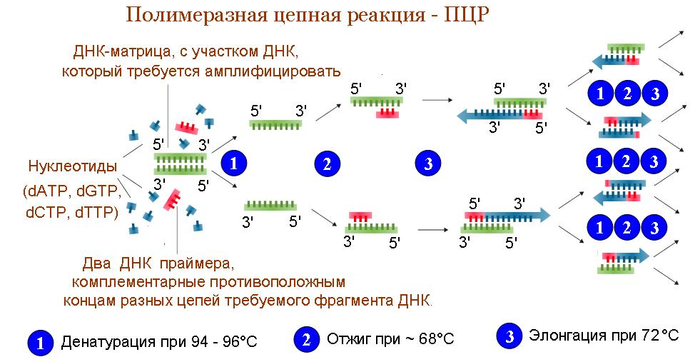
ПЦР. Ученые уже десятилетия изучают свойства ДНК. Выделяют из живых организмов, синтезируют искусственно... И довольно давно заметили, что было бы круто, если бы нужного им куска ДНК было МНОГО. Потому что когда его мало, то труднее ставить эксперименты - проще запороть, загрязнить чем-то чужеродным и т.п. И тогда в далеком 1983м один любящий галлюциногены ученый Кэри Муллис решил использовать для этого то, что давно уже придумала природа - репликацию, только искусственную, в пробирке. Нобелевку по химии за это получил, кстати... За основу взяли все основное, что есть в "натуральной" репликации - собственно ДНК, полимеразу, свободные буквы-нуклеотиды, чтобы ей было что вставлять в новую цепь, и праймеры - затравку, которая покажет полимеразе, откуда ей начать свое грязное дело. Путем долгих манипуляций и экспериментов выяснилось, что оптимальнее всего смешать все это и поставить на определенный температурный режим, где каждый этап реакции будет происходить на своей заданной температуре. Этапа всего три:
1) Денатурация. При 95 градусах двойная спираль ДНК распадается на две нити (разрушаются те самые слабые водородные связи между комплементарными нуклеотидами).
2) Отжиг праймеров. При 40-60 градусах (в зависимости от ряда факторов) маленькие затравки находят комплементарный участок на одиночной цепи и садятся на него.
3) Элонгация. При 72 градусах полимераза садится на затравку и начинает достраивать новую цепь, пользуясь старой как шаблоном. Откуда именно 72 градуса - очень интересная история о пользе фундаментальной науки, как-нибудь в другой раз.
Профит! В результате такого цикла из одной двойной спирали получаются две! Как несложно догадаться, теперь надо все это повторить еще раз, чтобы из 2 сделать 4, потом 8... Ну, вы поняли - это цепная реакция! За стандартные 30 циклов количество целевого фрагмента ДНК увеличивается в безумные 2^30 раз - теоретически, конечно, на самом деле эффективность ПЦР никогда не достигает 100%. Тем не менее, этого хватает, чтобы получить рабочие концентрации ДНК, с которыми можно уже делать серьезное дело.
Аппаратная база. Бедняга Муллис и его последователи сначала использовали тупо три водяных бани с разной температурой, вручную перемещая из одной в другую ценные пробирки с реакцией. Мы на практике в универе почему-то делали так же... Но как только мир понял, что ПЦР - это офигенно, сразу появились лабораторные приборы, которые этот процесс автоматизируют. Фактически это просто нагревательный блок, способный очень точно держать температуру в течение заданного времени и быстро его менять. называется такая штука термоциклер (англ. Thermocycler). Сейчас их на рынке пруд пруди, на любой вкус и цвет, чуть ли не кофе умеют готовить. Но как нам это все помогает при анализах на вирус?
Вот такой милаха прогонит ПЦР за полчасика
Медицинское применение. Появившись, ПЦР быстро превратилась из тупо копировального аппарата для ДНК в нечто большее. Подумайте сами: для успешной ПЦР нужна исходная ДНК, чтобы было, что копировать... Причем ее может быть изначально очень мало, но цепной характер реакции позволит нам ее приумножить. Но если изначально целевой ДНК в пробе нет, то и реакция не пройдет. Эврика! Берем кровь/кал/мазок/прочее у пациента, выделяем всю ДНК, что там есть. Добавляем полимеразу и праймеры, которые сядут именно и только на определенное место в ДНК какого-то интересующего нас патогена (ДНК патогена ведь сильно отличается от нашей). Запускаем реакцию и смотрим, прошла она или нет! Если прошла - значит, пациент был заражен этим патогеном, а на нет и суда нет. Получился очень точный, быстрый и относительно дешевый метод выявления патогенов - прикиньте, раньше пока анализ на какую-нибудь бактерию высеешь на питательную среду, дождешься, чтобы оно подросло, определишь, что выросло - несколько дней пройдет. А тут готовый результат за пару часов! Осталось только подобрать такие праймеры, чтобы они садились ("отжигались") действительно только на ДНК патогена, а не на человеческую ДНК. Этот трудоемкий процесс и называется созданием тест-системы - наверняка слышали такое словосочетание в новостях! Этим занимаются, как правило, крупные компании, вкладывающие в этот процесс большие деньги и время. Но тут что хорошо - один раз подобрал такие праймеры - и все, дальше любой лаборант с минимальным опытом сможет провести сам анализ.
Дальнейшее развитие ПЦР пошло по пути ответа на вопрос "прошла реакция или нет?". Логичным ответом на него стала ПЦР в реальном времени (англ. real-time PCR), о которой я, быть может, напишу отдельный пост.
Ну что ж, надеюсь, мне удалось приподнять завесу непонятного и слегка просветить любопытных! Это мой первый пост на Пикабу, не кидайте помидоры :-)
Картинки честно стырены с вики и гугла.