ПЦР: эпизод II – возвращение полимеразы
Дорогой читатель, с возвращением! В моем первом посте мы основательно разобрались с тем, что такое ПЦР, и как она работает. Узнали, что в клетках есть двойная спираль ДНК, а полимераза при делении клетки ее «копирует», достраивая вторую цепь на основе первой. Помогают ей в этом праймеры – небольшие кусочки однонитевой ДНК. В живых системах все это называется репликацией. ПЦР, по сути, это многократная репликация в пробирке – эдакий безумный ксерокс, штампующий нужный кусок ДНК в геометрической прогрессии. Этот метод взяли на вооружение врачи, чтобы находить малейшие следы ДНК патогенов в наших с вами телах (кстати, у животных тоже, разумеется). Главное – подобрать хорошую пару праймеров – и готова тест-система на какое-либо заболевание. Если реакция прошла – значит, патоген изначально присутствовал у пациента. Мы остановились на том, что осталось понять, прошла ли реакция, или нет. Как это узнать? Давайте разбираться.
В случае, если реакция прошла успешно, в нашей пробирочке окажется очень много ДНК. Если же реакция не прошла, ДНК будет на несколько порядков меньше. Как определить наличие ДНК? Ученые придумали много методов.
Один из самых простых – фотометрия. Суть метода в том, что многие вещества способны поглощать свет определенной длины волны. Например, кола в прозрачной бутылке на просвет покажется нам темно-коричневой, потому что она поглощает практически все волны видимого света. ДНК тоже поглощает свет, только в ультрафиолетовом диапазоне (около 260 нм). Чем больше ДНК – тем меньше ультрафиолета пройдет сквозь пробирку. Итак, берем пробирку после ПЦР, ставим в фотометр и меряем оптическую плотность. Современные приборы автоматически пересчитывают ее в концентрацию ДНК.
NanoDrop - один из самых популярных спектрофотометров. Для измерения хватит 2 микролитров - это меньше, чем слезка вашего хомячка
Метод очень простой, но неточный – результат зависит от множества факторов, типа загрязнения пробы. Кроме того, так мы узнаем, что ДНК есть, но не узнаем, какая именно. Это важно – ведь полимеразе, в общем-то, все равно, что реплицировать. Если мы ошиблись с праймерами, намудрили с температурным протоколом во время реакции или просто плюнули в пробирку, то на выходе получим не наш целевой фрагмент ДНК, а что-то другое, или, того хуже, смесь разных фрагментов. Такая неудачная ПЦР называется неспецифичной – адский кошмар для любого, кто работает в молекулярной лаборатории! Надо было что-то придумать, чтобы различать специфический фрагмент от мусора... Тут на помощь пришел другой аналитический метод –
Флуорометрия – тут все слегка сложнее. Есть такие вещества – флуорофоры. Они имеют любопытное свойство – если на них посветить (возбудить) светом определенной длины волны, они в ответ светятся (излучают), но другим светом. Светишь, например, на медузий белок GFP синим, а он тебе в ответ зеленым! Что еще круче, некоторые флуорофоры проявляют свои волшебные свойства только в том случае, если они связались с молекулой ДНК. Их называют умным термином «интеркалирующие красители». Классический пример, вызывающий икоту у любого молекулярщика – вещество под названием бромистый этидий (канцерогенное, кстати). Связываясь с ДНК, эта штука начинается светиться оранжевым, если на нее светить ультрафиолетом (кстати, зеленый свет тоже работает). Итак, поехали: бахаем в пробирку после ПЦР бромистого этидия, светим ультрафиолетом, и считываем ответное оранжевое свечение. Метод на несколько порядков более точный, чем фотометрия, но мы ведь так и не решили проблему с возможной неспецификой... Надо как-то отделить нужные фрагменты ДНК от ненужных. Это умеет делать другой метод в молекулярной биологии –
Электрофорез. Возможно, вы сталкивались с этим словом в медицине, когда вас нежно били током в разные места, но тут несколько другой случай. На сегодняшний день одним из самых распространенных методов в лабораториях сегодня является гелевый электрофорез, его и разберем. Рецепт прост: готовим (или покупаем готовый, если мы буржуи) из агарозы и воды холодец – реально как мамин холодец, только без мяса! Его называют просто гелем. В геле делаем луночки и заливаем в них наши образцы после ПЦР. Все это дело помещаем в специальную ванночку, в которой врубаем ток. ДНК в водном растворе имеет отрицательный заряд и под действием электрического поля начинает двигаться от минуса (катода) к плюсу (аноду). Но прикол в том, что через гель ей приходится протискиваться, причем длинным молекулам это дается сложнее, чем коротким. В итоге, если в пробе присутствуют молекулы ДНК разной длины, они сбиваются в стайки, бегущие с разной скоростью. В какой-то момент мы вырубаем ток, добавляем в гель интеркалирующий краситель (а иногда он заранее подмешан в гель), и смотрим на наше блюдо под нужной длиной волны.
Слева - форезная камера, в которой плавает гель, погруженный в буферный раствор. На геле видны лунки с образцами (их подкрашивают синим красителем)
Справа - фото геля после электрофореза. ДНК бежала сверху вниз. Первая дорожка - маркер, в остальных пробы. Светящиеся полоски - те самые стайки из фрагментов ДНК одного размера. Фото сделал я :-)
Если параллельно с пробой в одной из лунок прогнать смесь из молекул ДНК с заранее известной длиной (ее еще называют «маркер», или англ. DNA ladder), то, глядя на результат, мы сможем примерно подсчитать длину получившихся в ходе ПЦР фрагментов. А так как мы заранее знали, какой длины должен быть наш целевой фрагмент, то можем легко понять, имела ли место в данном случае неспецифическая реакция, или нет. Предвосхищая вопросы, замечу, что, если неспецифический продукт ПЦР имеет волею судеб ту же длину, что и целевой, то электрофорез, разумеется, не даст нам их различить.
Но все эти описанные выше методы требуют от нас делать что-то с пробой уже после того, как ПЦР прошла. Такой подход за это еще называют «ПЦР по конечной точке» (англ. End-point PCR). Но что если интеркалирующий краситель добавить прямо в ПЦР-смесь, и проверять, как он светится, после каждого цикла? Поздравляю, вы только что изобрели
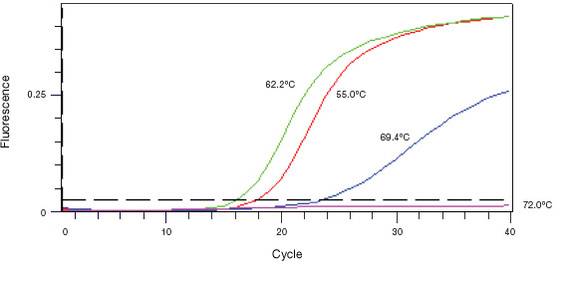
ПЦР в реальном времени. Атлант современной молекулярной биологии, этот метод дал ученым столько разных возможностей, что на описание всех их не хватит десятков постов. Суть проста: цикл за циклом количество наработанной ДНК увеличивается геометрически. С ДНК при этом связывается флуорофор-интеркалятор. Чем больше ДНК, тем ярче светится наша пробирочка. В конце каждого цикла мы детектируем ее свечение и строим график прироста флуоресценции – он называется кривой амплификации.
Кривая амплификации в qPCR. По горизонтали - циклы ПЦР; по вертикали - интенсивность свечения. Три кривые - три независимых образца. Автор фото явно указывает, что три образца прогнали при разной температуре отжига праймеров, и 62,2 градуса - самый лучший вариант, так как зеленая кривая начинает расти раньше, чем остальные.
Что нам это дало? Во-первых, теперь прямо в ходе реакции становится понятно, идет наша реакция, или нет. Не надо ждать конца реакции, грызя ногти от нетерпения, а потом еще ставить электрофорез на почти час. Во-вторых, если мы добавим в реакцию стандарты – пробы, где количество молекул ДНК известно заранее – мы сможем, сравнивая кривые амплификаций стандартов и нашего образца, путем нехитрых вычислений узнать, сколько копий ДНК изначально было в нашей пробе! Например, узнать вирусную нагрузку у носителя ВИЧ. Кстати, такая ПЦР будет называться количественной (англ. quantitative PCR, qPCR). Можно стандарты не добавлять, но сравнивать количество ДНК одного гена и другого – такое тоже часто бывает полезно.
В этом месте искушенный читатель заметит подвох – мы же выше выяснили, что решение с интеркалирующим красителем не избавляет нас от проблемы с детекцией неспецифики. Бромистому этидию, как вы понимаете, все равно, с чем связываться. Ведь отчасти для этого и ставят агарозный электрофорез – выявить ДНК нужного размера как светлую полоску на геле. Кроме того, используя интеркалятор, можно амплифицировать только один кусочек ДНК на пробирку – а что делать, если хочется больше? Но ученые и тут пошли еще дальше и модифицировали технологию ПЦР в реальном времени. Вместо добавления интеркалятора эти колдуны придумали детекцию прироста ДНК с помощью зондов.
Вот тут начинаются прям суровые дебри. Читатель, одумайся, еще не поздно закрыть эту вкладку и убежать смотреть посты с котиками! Волшебство в том, что теперь вместе с праймерами, специфичными к определенному участку ДНК, в реакцию вместо интеркалятора добавляется зонд – по сути тоже праймер, кусочек однонитевой ДНК, но на нем висят две молекулы разных флуорофоров – на разных концах зонда. Назовем их молекулы А и В. Зачем это все? Если мы в попытке возбудить молекулу А посветим на нашу смесь нужным светом, молекула А возбудится и начнет светить в ответ, но... Ее свет будет поглощен молекулой В, поскольку В возбуждается именно тем светом, который испускает А! Такие хитрые отношения называются «флуоресцентный резонансный перенос энергии» (англ. FRET – Fluorescence Resonance Energy Transfer). В итоге В светит в ответ совсем другим светом, нежели А, в то время как свет А вообще не регистрируется. Мы, улавливая этот свет, знаем точно, что молекулы А и В находятся рядом друг с другом, иначе FRET бы не работал. Ну и что, скажете вы? А хитрость метода в том, что полимераза при достраивании цепи ДНК как бронепоезд сносит все, что сидит у нее на пути – а наш зонд, как Анна Каренина, лежит именно там... Полимераза расщепляет зонд, и молекулы флуорофоров А и В разлетаются в разные стороны. Теперь В не мешает А светиться в свое удовольствие, а мы детектируем свет и А, и В. Чем больше света от А (его называют репортером, а В - гасителем), тем больше специфического продукта у нас получилось на данный момент – ведь зонд изначально сел на ДНК в строго определенном месте!
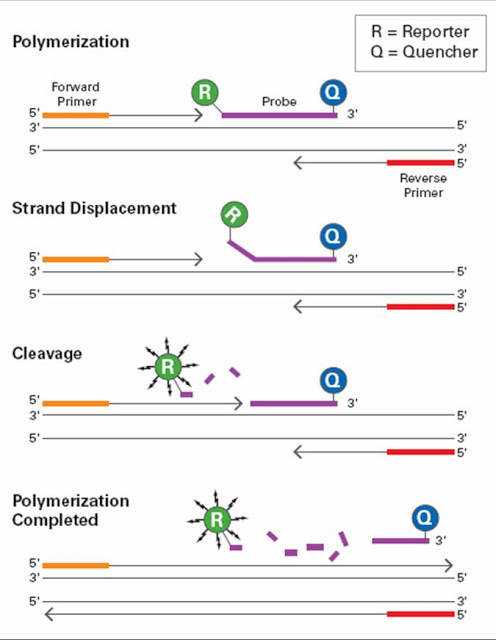
Схема работы зондов при qPCR.
1) Праймеры и зонд садятся на целевой участок ДНК
2) Полимераза начинает достраивать вторую цепь, при этом сталкивая зонд с первой цепи
3) Полимераза в итоге разрушает молекулу зонда
4) Полимераза достроила цепь до конца. Репортер (Reporter) радостно светится, а гаситель (Quencher) ему не может помешать.
На выходе мы имеем ту же самую кривую амплификации, только теперь она отражает прирост только целевого продукта, а не чего попало. Но и стоить такая ПЦР из-за зондов будет подороже, чем обычный вариант с интеркалирующим красителем... Зато теперь можно добавить прямо в одну пробирку праймеры и зонды для нескольких участков ДНК – например, для нескольких генов. Осталось использовать в зондах разные красители, чтобы они своим свечением не мешали друг другу – и вуаля, мы можем детектировать прирост концентрации двух и более участков ДНК одновременно! Такая ПЦР называется мультиплексной (англ. multiplex PCR). Представьте себе, теперь можно за одну реакцию найти у вас не только ВИЧ, но и гепатит, сифилис и микоплазму! Раньше для этого пришлось бы для каждой инфекции ставить отдельную реакцию – а это время и деньги. Вот счастье-то!
Хоть ПЦР в реальном времени и является продвинутой версией стандартной ПЦР, но на деле они не особо конкурируют друг с другом. В простых случаях, когда надо всего лишь наработать какой-либо фрагмент ДНК для последующей работы с ним, обычной ПЦР хватает. Такая ПЦР дешевле и проще. А вот ПЦР в реальном времени используют как самостоятельное приложение – для оценки концентрации ДНК, генотипирования, выявления уровней экспрессии генов, в медицине, и т.д. Этот метод закономерно дороже обычной ПЦР, требует специального оборудования – real-time PCR cycler. По сути, этот тот же термоциклер из прошлого поста, но теперь с лампочкой, системой светофильтров и камерой. Кроме того, к нему полагается программное обеспечение для анализа данных.
Вот такая штука нужна для проведения ПЦР в реальном времени. Стоит как однушка в Москве.
Выражаю свое глубочайшее уважение всем тем, кто выжил до этого момента! Надеюсь, моя история не обеспечит вам головную боль на остаток дня. Я рад, если вы открыли для себя что-то новое в увлекательном мире молекулярной биологии! В планах у меня пост о том, как работает технология геномного редактирования CRISPR, о которой многие наверняка слышали. До встречи!