Основы химии
Добрый день, мои маленькие химики. Сегодня мы с вами будем жечь еретиков познакомимся с понятиями орбиталь, принцип неопределенности и корпускулярно-волновой дуализм. У всех знания разные, поэтому буду писать для широкой аудитории понятным и простым языком. Начнем
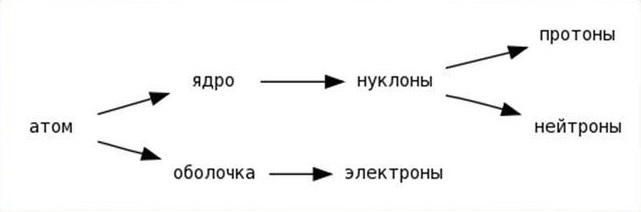
Мы знаем. что всё состоит из атомов и молекул (которые тоже состоят из атомов). В свою очередь атомы состоят из протонов, нейтронов и электронов
Начнем с центра атома - ядра. Ядро составляет большую часть массы атома и состоит из нуклонов. Нуклоны - это общее название нейтронов и протонов, т.к. по массе они отличаются незначительно. Записать это можно как: A=Z+N, где N-число нейтронов а, Z-число протонов (зарядовое число). Все просто
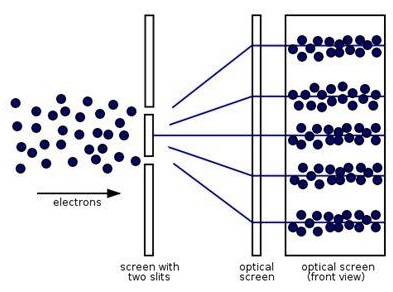
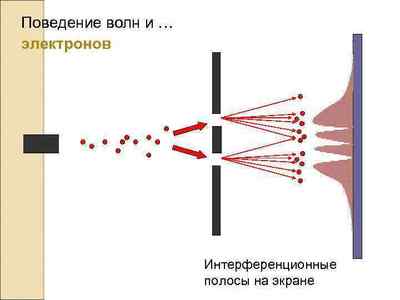
А теперь перейдем к главной проблеме этого поста: что же такое электрон? Электрон - это как бы волна, но как бы и частица. Именно это ученые и называют корпускулярно-волновой дуализм. Электрон можно рассматривать как волну, например, дифракция электрона. При этом идет образование спектра (вот те полосочки из точек)
А может как частицу (корпускула), т.е. обладает массой и зарядом. А если есть частица, то она способна к движению. Отсюда выходит еще одно страшное название: принцип неопределенности Гейзенберга. Чем точнее мы определяем одну из парных характеристик квантовой системы, тем более неопределенней становится вторая характеристика. Рассмотрим координаты и скорость (импульс только всех запутает). Чем точнее мы определяем скорость, тем сложнее нам сказать, в какой точке пространства находится электрон. И наоборот. Поэтому можно сказать, что электрон находится везде, т.е. размазан по поверхности атома.
Когда планета движется вокруг Солнца, она очерчивает путь, называемый орбитой. Подобным образом атом можно представить в виде электронов, кружащих на орбитах вокруг ядра. Согласно принципу неопределенности Гейзенберга, нельзя точно знать, где частица находится в данный момент и где она окажется потом. Орбиталь -это место, где будет находиться электрон 95 % времени.
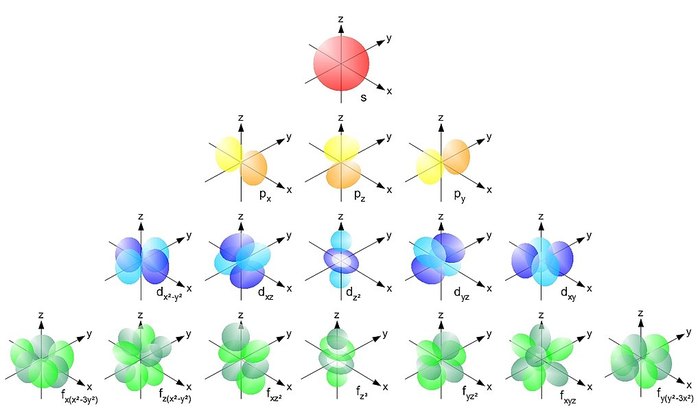
Различают несколько типов орбиталей:
- s-орбиталь. Принимает форму сферы. На ней может расположиться максимум 2 электрона;
- p-орбиталь. Принимает форму гантельки (второй ряд). На каждой из этих гантелек может находиться до двух электронов, но из-за того, что они могут быть ориентированы в пространстве относительно разный осей, получаем 6 электронов;
-d и f-орбитали - это группировка нескольких p-орбиталей.
А теперь немного о квантовых числах. Квантовые числа - энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
1.Главное квантовое число n характеризует общую энергию электрона и размер орбитали. Оно принимает целочисленные значения от 1: n = 1, 2, 3, 4, 5, 6, 7. Т.е. определяет, на какой по счету электронной орбитали находится электрон. На рисунке над каждой орбиталью подписала их квантовые числа
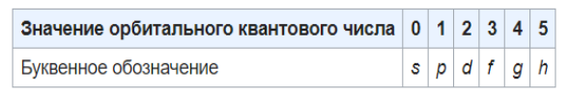
2. Орбитальное (побочное) квантовое число l характеризует форму атомной орбитали и принимает значения от 0 до n-1: 0, 1, 2, 3, …, n-1.
3.Магнитное квантовое число m характеризует количество орбиталей одинаковой формы и их ориентацию относительно внешнего электрического или магнитного поля. Квантовое число m принимает целочисленные значения в интервале –l, … –1, 0, +1, … +l. Для каждого значения разрешено 2l+1 значений числа m. Например, если l=1, то m имеет 2×1+1, т.е. 3 значения: –1, 0, +1. Показывает относительно какой оси ориентирована орбиталь
4.Спиновое квантовое число s характеризует вращение электрона вокруг своей оси и принимает только 2 значения: +1/2 (↑) и –1/2 (↓). Если говорить приблизительно. то это направление движения каждого электрона по орбитали. Важным условием является то, что на одной орбитали не может быть двух одинаковых спинов. Именно поэтому на одной орбитали не может быть больше двух электронов
А в следующий раз мы поговорим про различные типы половых связей и отдельно рассмотрим гибридизацию атомов. Если есть какие-то термины, которые не понимаете, то спрашиваем.