Перед вами – особая гигантская чаша Петри. Ученые поместили в нее питательную среду и добавили слоями антибиотики. Чем ближе к центру, тем концентрация антибиотика выше: в 10, 100, даже в 1000 раз. А по краям его нет. Вот бактерии размножаются и упираются в барьер. Но проходит время – и у бактерий случается мутация, которая позволяет его преодолеть. Мутация, дающая устойчивость к антибиотику. И вот потомки устойчивой бактерии начинают размножаться в сторону все большей концентрации антибиотика. Это повторяется с каждым переходом на новый слой. Барьер тормозит бактерий, но ненадолго. Темпы бактериальной эволюции поражают. Для полного захвата пространства потребуется меньше двух недель.
Так нас на глазах происходит самая настоящая эволюция. И мы даже можем прочитать ДНК этих бактерий и сказать, какая мутация и где произошла. Но, кроме эволюции, эксперимент наглядно показывает, как пугающе быстро и эффективно бактерии вырабатывают устойчивость даже к самым высоким концентрациям антибиотиков. А это – одна из самых громких проблем, волнующих современную медицину. Ведь у бактерии все чаще встречается набор невероятных способностей, помогающих им эту устойчивость вырабатывать и даже распространять.
А мы помним из истории, что происходило с людьми без антибиотиков. Были времена, когда практически любой чих мог оказаться смертельным. Однажды чума выкосила почти половину населения Европы. И именно благодаря антибиотикам мы перестали замечать болезни, которые когда-то были главной опасностью для человека.
Что будет, если антибиотики перестанут работать? Неужели скоро все бактерии станут к ним устойчивы, а люди начнут повально умирать от болезней, про которые уже успели забыть? Не хотелось бы вернуться в темное Средневековье с улицами, переполненными трупами! В мир, где каждый второй обезображен язвами и отваливающимися кусками плоти. В мир, где самая востребованная профессия уже не программист, а чумной доктор.
Но действительно ли нас ждёт такое будущее? Давайте разбираться!
История антибиотиков
В 1928 Александр Флеминг заметил, что появившаяся в чашке Петри плесень убила колонии бактерий золотистых стафилококков и оставила вокруг себя чистую зону. Микробиолог сделал вывод, что плесень выделяет нечто, убивающее микробов, и выделил вещество, спасшее впоследствии миллионы жизней.
Можно подумать, что антибиотики и тем более устойчивость к ним – это какое-то новомодное явление. Но, по данным некоторых исследований, гены, дающие устойчивость к этим веществам, появляются в эволюционной истории бактерий более миллиарда лет назад. Задолго до появления человечества. Ведь изначально антибиотики были страшным оружием в войнах одних микробов против других. Причем часто устойчивость к антибиотикам наблюдается у тех же самых микроорганизмов, которые их и производят. То есть какая-то бактерия, придумавшая антибиотик, также придумывает себе устойчивость, чтобы не умереть.
Из всего этого мы можем сделать интересный вывод, что антибиотики – вполне натуральное средство лечения. И антибиотики не изобретают, их открывают. Антибиотики в классическом понимании – это вещества, которые один микроб производит, чтобы убивать другого.
Бактерии, которые нас убивают
Самый простой способ понять важность антибиотиков – вспомнить чуму. С 1347 по 1351 гг. чумная палочка убила десятки миллионов человек, а это на тот момент от 30 до 50% жителей Европы. Эпидемий чумы было несколько, но эта была самая жестокая.
Конечно, нельзя сказать, что чума не повторяется в таких масштабах только из-за распространения антибиотиков. Не будем забывать, что ее самые страшные вспышки происходили во времена, когда санитария была, мягко говоря, не на самом высоком уровне. Но оценить эффективность антибиотиков мы все-таки можем. Ученые проанализировали 533 случая заражения чумой с 1942 по 2018 гг. При лечении с использованием наиболее эффективных антибиотиков смертность составила около 9%. А при использовании менее подходящих препаратов достигала 51%. Так что антибиотики действительно дают огромное преимущество.
Сегодня на смену чуме пришло множество других бактерий, которые нас убивают. В 2019 году бактериальные инфекции вызвали 13,7 млн смертей по всему миру. Из них 7,7 млн были вызваны 33 бактериальными патогенами. Эти же 33 бактериальных патогена вызывают 13,6% человеческих смертей.
Почему же эти бактерии так смертоносны? Они очень активно размножаются внутри нас, иногда проникая в клетки и повреждая ткани. Против них работает иммунитет, но его чрезмерная реакция может вызвать системную воспалительную реакцию, развивающуюся в сепсис. Это когда воспаление охватывает существенную часть организма. И происходит нарушение кровообращения и закономерная гибель тканей.
И да, я знаю, откуда готовилось нападение на наш организм. Распространенное оружие патогенных бактерий – экзотоксины.
Это яды, которые бактерии выделяют наружу. Чаще всего это белки, способные поражать самые разные ткани – нервные клетки, сердце. А еще среди них есть энтеротоксины — частный случай экзотоксинов, которые действуют именно на кишечный эпителий. Нарушают водно-солевой баланс, вызывая диарею и обезвоживание. Как холера. У разных бактерий токсины имеют свои «специализации», бьющие по разным мишеням.
И все же какие бактерии самые опасные? В упомянутом исследовании назвали пятерку самых опасных бактерий-убийц.
Первый враг – Staphylococcus aureus или золотистый стафилококк.
Бактерия живет на коже и слизистых почти каждого человека и в норме никому не мешает. Но при нарушении наших защитных барьеров или ослаблении иммунитета может превратиться из безобидного соседа в безжалостного хищника. Под микроскопом этот стафилокок напоминает грозди винограда, но не ведитесь на его внешний вид. Он производит мощные экзотоксины и гемолизины, разрушающие в том числе клетки крови. Именно эти токсины делают стафилококк виновником кожных воспалений и стафилококковой пневмонии. А еще за счет образования биопленок он может вызывать инфекционный эндокардит.
Особенно опасны штаммы MRSA. Это метициллин-резистентные золотистые стафилококки, устойчивые к большинству стандартных антибиотиков. А все потому, что эти мутанты выживают даже в тех местах, где, казалось бы, все должно быть стерильно. Например, в медицинских операционных.
Второй враг – Escherichia coli или кишечная палочка.
Большинство ее штаммов спокойно живут у нас в кишечнике и никого не трогают: участвуют в переваривании пищи, помогают синтезировать некоторые витамины, мешают размножаться другим микробам. Но у них есть злые двойники – патогенные штаммы, и некоторые из них вырабатывают шига-токсин. Этот токсин связывается с рецепторами на поверхности клеток кишечника и сосудов, проникает внутрь и поражает рибосомы – клеточные фабрики для синтеза белков. Лишенная возможности производить белки, клетка погибает, что приводит к кровавой диарее и, в тяжелых случаях, к гемолитико-уремическому синдрому, при котором разрушаются сосуды почек. Не забывайте мыть руки и овощи.
Третий враг – Streptococcus pneumoniae или пневмококк. Его главная хитрость — полисахаридная капсула, плотным «слизевым плащом» обволакивающая клетку и помогающая ей скрываться от иммунной системы.
Пневмококк может не только прятаться сам, но и создавать биопленки на слизистых – защищенные от атак города для бактерий. А еще может поселиться в легких, вызывая пневмонию, а может тайно проникнуть в мозг, что приведет к менингиту, или во внутреннее ухо, вызывая отит. Его смертельное оружие – пневмолизин. Белок-токсин, повреждающий клетки и вызывающий воспаление. Добавьте к этому большое количество устойчивых штаммов и получите по-настоящему опасное создание.
Четвертый враг – Klebsiella pneumoniae или клебсиелла пневмонии. Ещё одна бактерия, которая защищает себя полисахаридной капсулой, мешающей иммунной системе ее распознать и уничтожить. Но и биопленки создавать клебсиелла тоже умеет. Например, там, где человеку вставлен катетер или интубационная трубка.
Стоит ей попасть в легкие или кровь – начинается сущий ад. Особенно для диабетиков и алкоголиков. Пневмония, сепсис, воспаление легких, затрудненное дыхание и прочие ужасы. Но ее главный козырь – карбапенемазы. Ферменты, сметающие со своего пути даже те антибиотики, которые считаются «последней надеждой» при лечении тяжелых инфекций.
Пятый враг – Pseudomonas aeruginosa или синегнойная палочка. Ее суперсила – уже знакомые нам биопленки, защищающие от действия антибиотиков. Кроме того, она вооружена эффлюксными насосами – помпами, выкачивающими антибиотики наружу, и ферментами, разрушающими некоторые такие лекарства. Она может адаптироваться к нехватке кислорода, при определенных условиях менять состав своей клеточной стенки и прятаться в таких местах, где другие микробы не выживают. Именно поэтому ее так боятся ожоговые и реанимационные отделения. Если уж она поселились, выгнать ее почти невозможно. Ну а для нападения синегнойная палочка вырабатывает экзотоксин А, блокирующий синтез белка в клетках человека.
Именно эта пятерка – самые опасные бактерии, если не брать в расчет старый добрый туберкулез. Туберкулез в исследовании не учитывался, так как его посчитали чересчур изученным. Хотя по части смертносносности он чемпион. В одном только 2019 году он унес более млн жизней.
Бактерии потенциально способны к выработке антибиотикорезистентности, что делает их особо опасными. А со временем из них получаются супербактерии, устойчивые не к одному, а сразу к множеству антибиотиков.
И тут на сцену выходит восходящая звезда – ацинетобактерия баумани. Она уже приближается к рекорду в 400 тыс. смертей в год. А смертность при тяжелых случаях составляет от 26 до 91% – в зависимости от условий лечения и состояния пациента. ДНК одного из штаммов этой бактерии содержит крупнейший из известных островков устойчивости, включающий 45 генов, дающих защиту почти от любого класса антибиотиков. И она легко распространяет эти разнообразные устойчивости среди других бактерий.
Из-за роста смертности от связанных с ней инфекций и ограниченности вариантов лечения ВОЗ включила ацинетобактерию баумани в список приоритетных целей для разработки новых антибиотиков. Устойчивость – это зло. Но как мы тут оказались?
Дело в том, что бактерии чем-то напоминают зергов из компьютерны игры StarCraft. Они успешно пожирают останки себе подобных и захватывают чужие гены, а с ними и новые способности, в том числе устойчивость.
Облегчается такая передача тем, что часто гены устойчивости хранятся даже не в самой бактериальной хромосоме, а на маленьких кольцевых молекулах ДНК, плазмидах. Именно эти плазмиды бактерии копируют и передают друг другу.
Как работают антибиотики
А теперь давайте посмотрим на самые известные антимикробные препараты. Но для начала напомню, что антибиотики должен назначать врач. Они – не универсальная пилюля, которую можно принимать сколько вздумается и которая лечит все. Антибиотики отличаются по механизму действия и даже по тому, куда именно в теле они попадают. Одни лучше накапливаются в мочевом тракте и работают при цистите. Другие действуют в кишечнике.
Побочные эффекты у антибиотиков тоже разные: какие-то совершенно безобидные, но вот некоторые аминогликозиды могут привести к потере слуха, а хлорамфеникол – к смерти от апластической анемии. На некоторые антибиотики бывают аллергические реакции, вплоть до анафилактического шока. Что делать? Спросить об этом врача и принимать антибиотики по назначению, когда специалист взвесит пользу и риски.
И все же в самом фундаменте у антибиотиков есть важное общее правило. Чтобы они нам в принципе подходили, они должны бить по мишени, которая есть у бактерий, но которой нет у людей. Например, у бактерий есть клеточная стенка – прочный каркас, о котором наши клетки могут только мечтать. Значит, логично использовать антибиотики, которые будут целиться именно в эту стенку, ведь так они не заденут наши собственные клетки.
Так действует пенициллин. Это представитель β-лактамных антибиотиков. Что это значит? Его «мишенью» является синтез клеточной стенки бактерии. У большинства бактерий есть не только клеточная мембрана, но и прочная внешняя стенка. В ее составе пептидогликан, состоящий из аминокислот и сахаров. Почему стенка важна? Бактерия жадная и захватывает в себя массу полезных веществ, концентрация которых внутри становится сильно больше, чем снаружи. Чтобы это уравновесить, внутрь бактерии устремляется вода, распирающая бедняжку изнутри. Без стенки, сдерживающей такое внутреннее давление, бактерия просто лопнет.
Но хитрый пенициллин обманывает бактерию! Его молекула содержит β-лактамное кольцо, молекулярную структуру, очень напоминающую кирпичик, из которого строится стенка бактерий. Из-за чего белки-ферменты, ответственные за скрепление, принимают пенициллин за «своего» и используют его вместо настоящего кирпичика. В результате стенка формируется неправильно, так что при попытке деления клетка не выдерживает осмотического давления и взрывается.
Разумеется, бактерии не остались в долгу: многие из них выработали свой способ защиты. Они научились производить ферменты β-лактамазы, разрезающие β-лактамное кольцо пенициллина, ломая всю эту схему. В итоге стенка бактерий формируется нормально. Отсюда и происходит большая часть клинической устойчивости к пенициллину.
Но не будем забывать, что у нас с бактериями гонка вооружений! Каждый раз, когда они придумывают новые способы обхода наших ловушек, мы придумываем что-то в ответ.
Поэтому следующий наш герой – амоксициллин. Очень популярный антибиотик, производный от пенициллина из той же семьи β-лактамных антибиотиков. Его часто используют в стоматологии при удалении зубов и других процедурах, где важно не допустить инфекцию. Работает по тому же принципу: мешает бактерии построить нормальную клеточную стенку. Часто он идет в одной капсуле с клавулановой кислотой. Это молекула-ловушка, которая сама по себе не убивает бактерии, но связывает и блокирует β-лактамазу. Пробиваем бактерии ее щит, а затем бьем по ней амоксициллином.
А вот популярный антибиотик с совершенно другим принципом работы – тетрациклин. Он не ломает стенки бактерий, а бьет по фабрикам синтеза белка – рибосомам. И это отдельный пример шедевральной эволюции лекарств. У всех живых организмов – и у бактерий, и у людей – есть рибосомы. Молекулярные заводы, где синтезируются белки. Но бактериальные рибосомы отличаются от наших. Они меньше и устроены чуть иначе. Поэтому тетрациклин может работать избирательно, не задевая человеческие рибосомы, но попадая в бактериальные. Он прицельно связывается с так называемой 30S-субъединицей бактериальной рибосомы, мешая ей присоединять новые аминокислоты к растущей цепочке белка.
Что это значит на практике? Бактерия перестает производить белки, а значит не может делиться, вырабатывать токсины и вообще существовать как полноценная живая система. Наша иммунная система получает передышку и спокойно добивает ослабленного врага. Это не мгновенное убийство, а что-то вроде заморозки. Бактерию ставят на паузу и добивают.
Какие способы могут использовать бактерии, чтобы выработать устойчивость к тетрациклину? Самый простой вариант – модификация мишени. Если тетрациклин цепляется за 30S-субъединицу рибосомы, с помощью мутаций надо всего лишь поменять ее структуру. И тогда тетрациклин больше не сможет с ней связаться. Приходится придумывать новый план.
Или бактерии могут использовать более общие методы. Например, мешать тетрациклину попасть внутрь клетки, делая свою мембрану менее проницаемой. Или установить эффлюксные насосы, которые будут выкачивать антибиотики наружу. Механизмы защиты могут быть самыми разными и бактерии бывают очень изобретательны. Это касается не только тетрациклина, но и других антибиотиков.
Устойчивость к антибиотикам
Давайте сразу разберемся с очередным мифом. Если человек заразился устойчивыми бактериями, это еще не значит, что он раньше как-то не так принимал антибиотики. Бактерии могли получить эту устойчивость вообще без прямого контакта с людьми. Например, на ферме. Пролечили условных свинок антибиотиками, подстегнули эволюцию устойчивости, а потом этих устойчивых бактерий по цепочке доставили куда не надо. А там эти гены устойчивости передалась другим, теперь уже опасным для человека бактериям.
Еще стоит отметить, что устойчивость к антибиотикам – это скорее спектр. Бактерия может быть более или менее устойчива. Маленькая дозировка может ее не взять, а вот большая поможет. Хотя при большой дозировке могут быть уже свои побочные эффекты для человека.
Устойчивость – это не эксклюзивное явление, свойственное только антибиотикам. Она может выработаться практически к чему годно. Вирусы могут становиться устойчивыми к противовирусным, а раковые клетки – к химиотерапии. Все, что может эволюционировать, будет эволюционировать.
Некоторым очень хочется трактовать устойчивость как месть природы за человеческую самонадеянность. Да, люди прямо или косвенно помогают распространять устойчивости. Особенно когда злоупотребляют антибиотиками или принимают их для профилактики. Но феномен устойчивости существовал безо всякого нашего вмешательства миллиарды лет. И был одним из методов борьбы микробов друг с другом.
Но то, что человек в эту борьбы вмешался, никто не отрицает. Исследования показывают, что, когда люди массово используют антибиотик, доля устойчивых к нему штаммов начинает стремительно расти.
Долгое время бытовало мнение, что курс антибиотиков обязательно нужно пропить до конца, иначе недобитые бактерии станут только сильнее. Идея звучала логично, но сейчас сроки некоторых курсов пересматривают. Оказалось, что слишком длинный курс антибиотиков может быть даже вреден, ведь чем дольше бактерии контактируют с препаратом, тем больше у них шансов выработать к нему устойчивость. И речь не обязательно про патогенные бактерии: устойчивость могут выработать и обычные бактерии. И передать. В некоторых случаях короткие курсы оказывались не менее эффективными, чем длинные, а риск возникновения устойчивости с ними порой был ниже.
Увы, в эпидемиологии есть печальная, но честная закономерность: чем больше давление антибиотиком, тем больше к нему резистентность. Но есть и хорошая новость. У всего есть своя цена – и у устойчивости к антибиотикам тоже. Мутации, делающие бактерию более стойкой, могут в итоге ей же и навредить. Измененный в ходе мутаций фермент начинает хуже работать, насосы тратят лишнюю энергию, а менее проницаемая мембрана мешает обмену некоторых веществ.
Когда антибиотика нет, гены устойчивости становятся для бактерии балластом. Представьте, что вы научились печь идеальный пирог с идеальным составом. Каждый ингредиент подобран в оптимальной пропорции. Но тут к вам приходят гости с особыми требованиями: глютен нельзя, сахар нельзя. Вы, конечно, корректируете рецепт, вот только вкус уже не тот. И когда гости уйдут, вы, скорее всего, вернетесь к прежнему варианту готовки.
Так и бактерия. Чтобы защититься от антибиотика, она вынуждена «переделать рецепт» своих молекул. В присутствии лекарства это помогает, выбора нет. Но стоит лекарство отменить… и те же адаптации – уже не адаптации, а то, что делает бактерию менее приспособленной.
Эксперименты показывают, что устойчивость к антибиотикам может значительно снижаться уже в пределах примерно 480 поколений бактерий (около 60 дней). Конечно, это зависит от конкретного антибиотика и конкретной бактерии. Иногда бактериям удается компенсировать вред от устойчивости другими компенсаторными мутациями, но далеко не всегда. И хотя бывают и почти бесплатные мутации, дающие устойчивость и мало на что влияющие, но и они в отсутствии давления естественного отбора постепенно выветриваются. Просто за ненадобностью.
Это помогает нам прийти к важному выводу – если расплодились бактерии, устойчивые к антибиотику, логичным решением будет временно перестать использовать ставшее малоэффективным лекарство. А чем тогда лечить? Придумывать новые антибиотики?
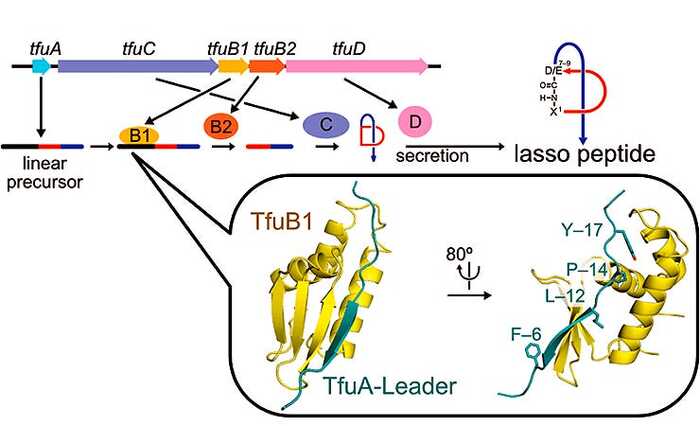
Между 1962 и 2000 гг. на рынок почти не приходили принципиально новые классы антибиотиков. К счастью, буквально недавно ситуация стала меняться. Так, недавно в Nature вышла работа о лассо-пептидах.
Если посмотреть на их структуру, они и правда выглядят как ковбойское лассо, затянутое узлом. И вот недавно среди них был открыт новый антибиотик – пептид лариоцидин, отличающийся принципиально новым способом борьбы с бактериями. А новый способ – это хорошо: значит, прежняя устойчивость не поможет.
Как и тетрациклин, лариоцидин воздействует на бактериальные рибосомы. Вот только цепляется за другой их участок, вызывая «сбой» в кодировании белков. И он не подвержен привычным механизмам устойчивости, имеет низкую склонность к спонтанной резистентности и, по-видимому, не токсичен для клеток человека.
А еще ученые пишут, что это вообще совершенно новый химический шаблон, на основе которого можно будет сделать целую серию антибиотиков. Ведь это белок, а значит, кодирующий его ген можно модифицировать, создавать новые версии, добавлять устойчивость к разрушению, менять форму петли и т.д.
Но и это еще не все в нашем растущем арсенале. Весной 2025 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило препарат Blujepa c действующим веществом гепотидацином. Он предназначен для лечения неосложненных инфекций мочеполовых путей у женщин. И это первый за почти 30 лет новый класс оральных антибиотиков, одобренный для лечения такого рода инфекций. В клинических исследованиях он показал себя не хуже, а иногда и лучше стандартной терапии.
Как и привычные препараты, гепотидацин бьет по тем же ферментам, которые помогают бактериям разматывать свою ДНК при копировании, но цепляется к другому участку. Такой подход помогает обойти старые мутации устойчивости.
А журнал Science представил миру Крезомицин — антибиотик, который работает и против грамположительных, и против грамотрицательных бактерий.
Крезомицин придумали с нуля. Это полностью синтетический антибиотик, заранее подогнанный под бактериальную рибосому. Он садится в рибосоме особенно плотно и в нетипичном положении, поэтому обходит ключевые механизмы устойчивости и плохо допускает возникновение устойчивых мутаций.
Так что наука не стоит на месте – и это очень радует! Находятся и создаются новые методы, подходы и мишени даже для тех микробов, которые казались непобедимыми. Но антибиотики – это не все, что мы можем противопоставить нашим прокариотическим оппонентам.
Альтернативные способы
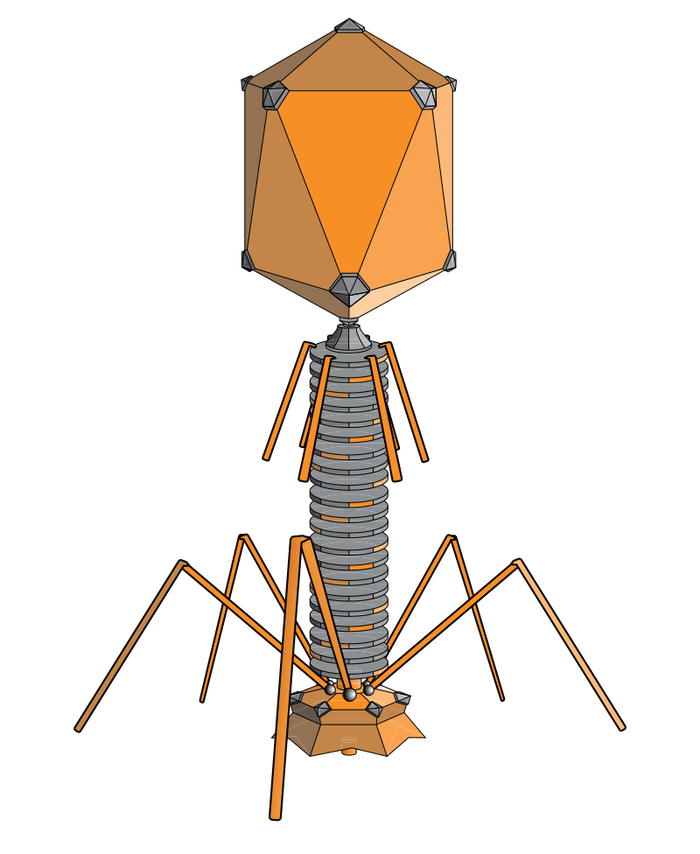
Представляю вашему вниманию бактериофаги.
Это такие вирусы, которые избирательно заражают бактерии и убивают их. Для бактерии – страшный враг, для нас абсолютно безобидны. Мы их переварим на нуклеотиды и аминокислоты. Идея не нова – разговоры ведутся уже десятки лет. Тем не менее, до сих пор нет ни одного лекарственного препарата на основе бактериофагов, одобренного FDA – управления по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Тем не менее, недавно в Nature опубликовали большой обзор ста случаев, когда людям с устойчивыми к антибиотикам инфекциями фагов подбирали индивидуально. Результаты оказались интересными. У 77% пациентов наступило клиническое улучшение, а у 61% зловредные бактерии были полностью уничтожены. Но не обошлось без подвоха. Без параллельного приема антибиотиков шанс полного уничтожения снижался на 70%. То есть победить бактерий без антибиотиков даже с фагами пока еще весьма проблематично.
Есть еще один неожиданный способ борьбы с инфекциями — пересадка кала. Главные враги бактерий – это другие бактерии. И наша нормальная кишечная флора защищает от патогенных видов самим фактом своего существования. Ведь местные не хотят делиться ресурсами и местом обитания, а тут какие-то патогены понаехали. Поэтому здоровая микрофлора — это такой телохранитель кишечника.
Клинически доказано, что пересадка кала помогает при конкретной тяжелой инфекции Clostridium difficile, устойчивой к антибиотикам. Этот метод даже официально одобрен медицинскими регуляторами в ряде стран. Но процедура очень кропотливая, ведь ни в коем случае нельзя занести пациенту дополнительных инфекций. Именно поэтому важен тщательный подбор донора. И это совсем не такой подбор, как при поиске донора почки. Важна не совместимость тканей, а отсутствие опасных инфекций. Но не занимайтесь пересадкой кала самостоятельно в домашних условиях. Не слушайте биохакеров, которые говорят, что их жизнь изменилась после того, как они ввели себе кал своего друга. Такие есть!
Бывший исследователь NASA и биохакер Джосайя Зайнер попытался вылечить хронические кишечные болезни, сделав себе самодельную пересадку микрофлоры.
Он просто выпил кал друга, даже не проверив его на инфекции. Теперь он рассказывает, что чувствует себя новым человеком. Хорошая история, но не забываем ошибку выжившего. Тем, кому пересадка кала помогла, мы услышим. А те, кому она навредила, никогда не признаются, что просто так жрали… ок. Лучше делать по показанием и с врачом.
Больницы
Сильнее всего устойчивость к антибиотикам развивается там, куда люди приходят лечиться. Больницы – идеальное место для эволюции бактерий. Здесь антибиотики льются рекой, есть приток свежего биоматериала в виде новых бактерий, сами бактерии свободно обмениваются генами устойчивости, пациенты с самыми разными инфекциями оказываются рядом, а ослабленный иммунитет часто делает их легкой добычей и полигоном для новых витков эволюции.
Это не призыв не ходить в больницы. Ваши шансы умереть без медицинской помощи все равно выше, чем с ней. Но очень важно, чтобы клиникам выделяли средства на поддержание всех санитарных норм на высочайшем уровне. Хорошая вентиляция, регулярная уборка, новый ремонт, контроль влажности, обработка поверхностей ультрафиолетом — всё это не мелочи и не формальность, а лучший способ бороться с бактериями.
Вспышки заболеваний вроде болезни легионеров – болезненное напоминание, что пренебрежение санитарией убивает не меньше, чем неправильное лечение. В 1976 году сотни ветеранов были заражены и десятки умерли просто из-за загрязненных систем кондиционирования воздуха в отеле на съезде Американского легиона.
Виновница – Legionella pneumophila, бактерия, которая коварно проникает в легкие, поселяется внутри клеток иммунной системы и начинает размножаться прямо там.
Так что устойчивость к антибиотикам – ещё и про среду. Чем грязнее и плотнее пространство, чем хуже циркулирует воздух и моются поверхности, тем легче бактериям приспосабливаться и обмениваться устойчивостью.
И напоследок
Бактерии ежегодно уносят миллионы жизней. И хотя альтернативные методы внушают оптимизм, нашей главной надеждой остаются антибиотики. Именно поэтому устойчивость к антибиотикам — реальная угроза. И она растет по совершенно базовой причине – эволюции. Мы закидываем бактерии все новыми лекарствами, но каждый раз они к ним адаптируются. И мы сможем выигрывать в этой борьбе, только если чаще будем обращаться к науке. И к здравому смыслу.
Не принимать антибиотики «на всякий случай». Не экономить на уборке и стерилизации помещений. Не перекармливать антибиотиками животных, превращая фермы в инкубаторы устойчивости. И, конечно, не забывать про прививки, важнейший инструмент защиты от инфекций. Ведь если мы привиты, нам реже нужно обращаться к антибиотикам. Да, против того же туберкулеза существует прекрасная вакцина. Есть вакцина от возбудителя столбняка Clostridium tetani, есть вакцина от гемофильной палочки, менингококка и пневмококка, есть вакцины от сальмонеллы и холеры.
Желание бактерий выжить любой ценой естественно. И они подходят к нему с умом. Давайте постараемся составить им достойную конкуренцию. Неизвестно, сможем ли мы когда-нибудь полностью защитить себя от бактерий. Но уж точно можем сделать для этого все, что в наших силах. И тогда мы, возможно, не умрем.
Подписывайтесь на соц. сети:
Мой авторский цикл лекций
Еду в осенний тур с лекцией «Радикальное продление жизни»
Билеты и подробности — здесь.