Смотрите это видео без рекламы и VPN по ссылке ↗
Людям не хватает органов. Чаще всего — почек, печени и сердца. Только в США сейчас трансплантации ожидает более 104 тыс. человек. Коммерческое донорство запрещено практически везде. Нет, ты не можешь продать почку на Авито. В некоторых странах, например, в России существует презумпция согласия, когда после смерти вы автоматически становитесь донором, если при жизни не указали обратное. Но это работает далеко не везде. Так, во многих мусульманских странах донорство не приветствуется.
В республике Бангладеш донорами по закону могут быть только родственники. При этом местные священнослужители активно выступают против пересадки органов. Якобы она нарушает святость человеческого тела. Под их влиянием многие отказываются от донорства или трансплантаций. Хотят, чтобы их хоронили нетронутыми, чего бы это ни стоило. Мёртвое тело важнее жизни живого. К вопросу о религии.
Но даже светская Швейцария одобрила презумпцию согласия только в 2022 году — и до сих пор её не ввела. А до этого у них считалось, что такая система нарушает право на физическую неприкосновенность тела и не уважает желания умершего.
Тем временем траты на медицинское обслуживание людей, ожидающих пересадки, с каждым годом увеличиваются. Например, людям в очереди на почку нужен диализ. А ещё семья донора в последний момент может изменить решение. И за кулисами этой драмы — настоящий триллер под названием «Рынок черной трансплантологии». Торговля людьми, фейковые группы поддержки, где предлагают приобрести почку нигерийского принца за бешеные деньги, и неуловимые врачи-оборотни. По некоторым данным, более 10% мировых трансплантаций проводятся незаконно.
Поговаривают, что богатые люди могут позволить себе сколько угодно почек. И печень меняют после каждого Нового года. На этот счет даже есть мем про Рокфеллера. Якобы к 99 годам он сделал шесть пересадок сердца. На самом деле эту байку запустил сайт фейковых новостей World News Daily Report. Если что, это был жирный намек на бессердечность и привилегированность элит.
Короче, людям нужны органы. Но где их взять? Достаточно научиться создавать в большом количестве молодые, крепкие, функциональные органы. Всего-то! Но что, если я вам скажу, что прямо сейчас развиваются не один, не два, не три, а целых четыре инновационных биотехнологических подхода, каждый из которых потенциально может решить проблему нехватки органов?
В массовой культуре полно антиутопических сценариев про выращивание клонов на органы. Например, фильм Майкла Бэя «Остров».
Или вот в книге Нобелевского лауреата Кадзуо Исигуро «Не отпускай меня» людей с детства воспитывают как будущих доноров.
Есть даже генетическая опера «Repo! The Genetic Opera». Сюжет в том, что есть суперкорпорация GenCo, которая предоставляет органы в ипотеку. Если человек вовремя не расплачивается, к нему приходит Рипомен, Конфискатор. И эти органы насильственно изымает. Обычно с летальным исходом.
Сразу скажу, что решение, конечно же, не в этом. Да, отдельные ученые рассуждают о том, что можно было бы выращивать, например, клонированные тела без мозга, с каким-нибудь генетическим дефектом, чтобы обойти этические барьеры. Но всё равно вынашивать эти тела должны будут женщины, рискуя своим здоровьем, причем больше, чем при обычной беременности. Увы, полноценную искусственную матку пока никто не изобрел, хотя в этом направлении и идут работы. Да и вероятность смерти безмозглого клонированного тела будет высокой, а уход за ним – дорогим: искусственное питание, вентиляция легких, борьба с пролежнями, инфекциями. Короче, тут я скептичен.
Но фантазии про клонов появились не на пустом месте. Первой пересадкой целого органа в истории человечества была пересадка почки от клона к клону. Операцию провели между братьями Ричардом и Рональдом Херриками. Они были однояйцевыми близнецами. То есть технически они были клонами, генетически идентичными организмами.
Это случилось в 1954 году. И это был настоящий шок для общества, которое испугалось новой технологии. Как сейчас боятся ГМО и 5G. Многие СМИ считали операцию глубоко неэтичной и пророчили смерть обоих братьев. Сам реципиент, Ричард Херрик, был против. И даже послал брату из палаты записку — «Убирайся отсюда и вали домой». В ответ получил «Я здесь, и я останусь».
Однако операция прошла блестяще. Реципиент быстро окреп. Настолько, что даже женился на медсестре отделения.
А вот некоторые последующие аналогичные операции, уже с людьми, не идентичными генетически, заканчивались плохо. Главной проблемой было отторжение органа, иммунная реакция. Эта проблема остается ключевой и сегодня. Поэтому если речь не идет об однояйцевых близнецах, приходится принимать особые меры. Например, не только искать генетически подходящих доноров, но и давать человеку иммуносупрессанты. Они помогают органу прижиться. Но одновременно подавляют иммунную систему и повышают риск инфекционных и онкологических заболеваний.
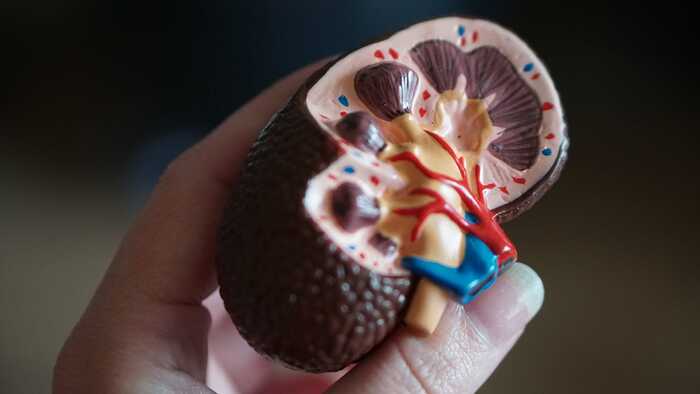
За то, приживется ли орган, у нас отвечает набор генов на шестой хромосоме, — МНС, он же «главный комплекс гистосовместимости». Одна из его функций — давать клетке возможность рассказать иммунной системе о том, что у нее внутри. Молекулы MHC хватают кусочки белков изнутри клетки и выставляют их на поверхность. Декларируют, так сказать, содержимое. Как чемодан на таможне. А клетки иммунной системы их «сканируют» и определяют, нормальные это пептиды или запрещенка. Не провозит ли клетка биологическое оружие вроде вируса? Или просто чужеродные гены.
И в этом причина, по которой органы одного человека часто не подходят другому.
Если бы у всех нас комплексы гистосовместимости были одинаковые, то какой-нибудь вирус рано или поздно этим бы воспользовался. Скажем, обзавелся белками, которые не распознает этот MHC. То есть невидимые для таможенной полиции. И заразил бы нас всех без исключения. Поэтому эволюция подтолкнула нас к невероятному разнообразию генов комплекса гистосовместимости.
Но для иммунной системы расхождение в этих генах, которое мы получаем при пересадке, выглядит как попытка скрыть контрабанду. Сколько евро везете? — А я вам не скажу! — Гражданин, пройдемте.
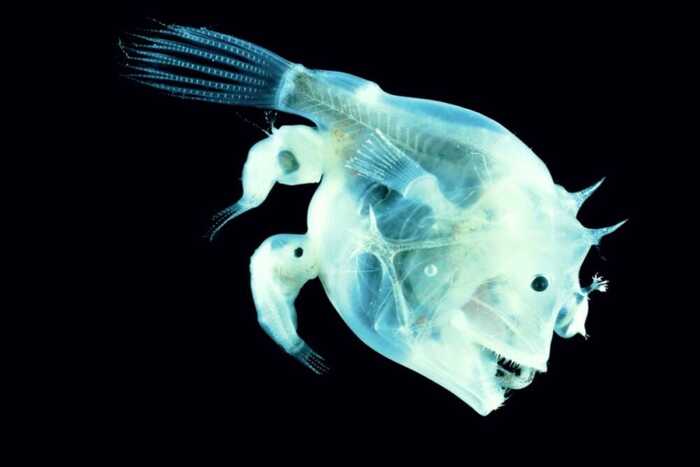
Есть забавная история о том, как проблему отторжения чужого органа решает природа. Радикально. Есть такая глубоководная рыба — удильщик. Типичный самец удильщика в 40 раз меньше самки «удильщицы».
Найдя подходящую самку, он без промедлений совершает кусь. Присасывается — и через некоторое время становится, по сути, спермобаком. Отдельным органом самки, с которой сливается анатомически. У них общая кровеносная система, общие друзья, общие интересы — успокаивают себя рыбы-удильщики, постепенно утрачивая собственное «Я». Ставьте лайк, если знакомая ситуация.
Со временем самка может завести себе еще несколько спермобаков. Максимально на самке их было зафиксировано восемь. Все они интегрируется в женское тело. И вот что удивительно: никто не отторгается. Ученые попытались понять, как такое возможно. И оказалось, что в процессе эволюции рыбы-удильщики потеряли как раз некоторые из генов комплекса MHC. И еще пару генов, связанных с иммунитетом. За спермобаки пришлось заплатить страшную цену.
Но мы не удильщики. А еще у большинства из нас нет запасных органов в теле однояйцевого близнеца. И даже если есть, вряд ли мы мечтаем разобрать родного человека на запчасти. Поэтому ученые активно пытаются придумать, где взять органы, которые:
всегда были бы под рукой;
не вызывали бы отторжения, а желательно просто идеально подходили;
производились без особых ухищрений.
Как такие органы сделать? Есть по меньшей мере четыре подхода. И сейчас я о каждом подробно расскажу.
Первый подход: человеческие органы в животных
Химера – это любое животное, состоящие из клеток с разной ДНК. Название идет от знаменитого мифического огнедышащего существа, отчасти льва, отчасти змеи, отчасти козы.
В реальности химера – любое существо, которое состоит из генетического материала двух и более организмов, можно даже одного вида. Та самая рыба-удильщик с торчащим из бока самцом-спермобаком – тоже химера.
Наверняка вы в курсе истории Лидии Фэрчайлд. В 2002 году она подавала на алименты на двоих детей и должна была подтвердить материнство с помощью обычного ДНК-теста. Но неожиданно из теста Лидия узнала , что ее дети… не ее дети.
Опека оказалось под угрозой, а Лидию были готовы обвинить в мошенничестве. Ей пришлось пройти еще три повторных теста, но результаты оставались неизменными: материнство не подтверждалось. В этот момент Лидия была беременна третьим ребенком. Рожать его пришлось при свидетелях. Лидии и младенцу сделали тесты, и они снова показали, что мать… не мать. И тут даже судья начал что-то подозревать.
Наконец нашелся пытливый адвокат, который раскопал аналогичный случай с другой женщиной, Карен Киган, у которой был обнаружен химеризм. Это редкое отклонение, при котором у человека два набора ДНК. Один набор его, другой – потенциального близнеца, который был бы братом или сестрой, если бы клетки их зародышей в утробе не соединились в один организм. Лидии провели очередные тесты. И наконец в мазке из шейки матки нашли-таки потерянный набор ДНК. Дело было закрыто.
Примерно так это происходит в естественной среде. Хотя не всегда столь драматично. Иногда химеризм имеет внешние признаки, например, у человека или питомца могут быть глаза разного цвета. А иногда о нем можно и не подозревать.
Возможен ли химеризм между видами? Можно ли вырастить орган одного животного в другом животном? Первую искусственную химеру удалось создать в 1993 году. Ученые из медицинской школы университета Гарварда придумали технологию под названием “комплементация бластоцист”. Они сделали мышей без нормального адаптивного иммунитета, поломав один важный ген. Мутация в этом гене приводит к тому, что мышка не может формировать правильные B и T-клетки, поэтому вся адаптивная иммунная система у нее не работает. Скажем, такая мышка не сможет выработать иммунитет после вакцинации. Похожий ген был поломан у рыб-удильщиков.
Далее ученые добавляли к эмбрионам таких мышей небольшое количество эмбриональных клеток нормальной мышки, у которой с генами иммунитета все в порядке. Бластоциста — это стадия развития эмбриона, на которой они это делали. Маленький комочек клеток, который образуется на 3-4 день после оплодотворения. А сама процедура как раз и называется «комплементация бластоцист». В результате комплементации из эмбриона выросла взрослая химера-мышь. Почти все клетки у нее были с генетическим дефектом, но при этом развилась нормальная адаптивная иммунная система. И все клетки этой системы ведут свою родословную только от генетически правильных, добавленных клеток.
И вот то же самое можно сделать с самыми разными клетками. Для комплементации главное – чтобы у эмбриона была какая-то генетическая мутация. Из-за этой мутации при развитии плода какая-то часть тела вообще не формируется.
Это пустующее место называют «ниша развития», developmental niche. Заполнить эту пустоту можно, если добавить в эмбрион генетически нормальные чужеродные клетки. Из них и вырастет недостающий орган. Получается самонаводящийся процесс: добавил клетки, освободил пустоту, и они ее заполнили. Так ученые создали химерных мышей, у которых почки или легкие состояли из клеток другой мышки. А в 2010 году произошел прорыв. С помощью похожей технологии ученые из университета Токио создали мышь, у которой поджелудочная железа была из клеток крысы. Для этого ей сломали ген Pdx1, он отвечает за белок, критически важный для развития поджелудочной железы. Если сломаны обе копии этого гена, мышь рождается без этого органа и быстро умирает. Но тут в эмбрион добавили стволовые клетки крысы – и поджелудочная железа возникла. И состояла она по большей части из клеток крысы.
Это значит, что теоретически можно выращивать человеческие органы в животных. Только вот где нам брать человеческие эмбриональные клетки, чтобы подмешивать в звериные эмбрионы? С учетом такой напряженной дискуссии вокруг абортов?
Бесконечные эмбриональные клетки
К счастью, никакие человеческие эмбрионы нам и не нужны. Эту проблему решил Синъи Яманака, и за свое решение уже получил Нобелевскую премию по физиологии и медицине. Это, наверное, одна из важнейших сегодня технологий после CRISPR/Cas9.
Яманака показал, что мы можем взять у любого человека взрослую клетку, ввести в нее несколько генов — и откатить эту клетку в эмбриональное состояние. Эти гены назвали «факторы Яманаки». И вот такую человеческую клетку можно подсадить в зародыш какого-то животного. Понятно, что в мышке человечью почку вырастить не получится. Размеры не те. Но, например, органы свиней по размерам подходят.
Есть такой миф, что человек якобы ближе к свинье, чем к шимпанзе, — иначе зачем бы еще нам пересаживали свиные сердечные клапаны? Но нет, это не так.
Конечно, все живые организмы на планете — родственники. Даже бобер курва нам родственник! Но на самом деле свинья от человека генетически довольно далека. Вся прелесть свиней в том, что их органы прекрасно подходят нам по размеру, что сердце, что почки. В случае со свиными сердечными клапанами, которые действительно активно используются в медицине, отторжение не возникает только потому, что с них смывают все клетки свиньи. Остается только каркас. Он не вызывает такого иммунного ответа, и клапаны могут спокойно функционировать много лет.
Но если мы хотим взять у свиньи орган, он должен подходить человеку генетически. И один из способов этого избежать – как раз создать химеру человека и свиньи.
Первую такую химеру описали в 2017 году. Авторы хотели сделать свинью с человеческой поджелудочной железой. Они взяли клетки человека из крайней плоти — и откатили их в эмбриональное состояние с помощью «омолаживающих» факторов Яманаки. Затем эти клетки добавили в свиные бластоцисты, откуда изъяли ген, нужный для создания поджелудочной. Часть человеческих клеток интегрировалась и прижилась в теле зародыша.
Увы, в итоге «уровень химеризма», то есть доля чужеродных клеток в органе, оказался значительно меньше, чем в эксперименте с крысой и мышкой. Может, потому, что все-таки свиньи от людей генетически сильно дальше, чем мышки от крыс. Полноценного человеческого органа в свинье не получилось. Если что, до взрослых животных дело там не доходило, изучали все на эмбрионах.
Та же группа ученых позже опубликовала работу про создание химеры человека и обезьяны. Тоже пока лишь на уровне эмбриона.
Короче, определенные успехи есть. Но говорить, что мы научились выращивать расово верные человеческие органы в животных, пока рано. Прежде чем вся эта технология с комплементацией бластоцист начнет спасать жизни, нужно ее доработать. Как будем это делать?
Давайте представим, что мы создали химерную свинью, у которой растет человеческая поджелудочная железа. Но, например, кровеносная система, которая снабжает этот орган кровью, все равно будет состоять из клеток свиньи. Это не оптимально. Ведь на сосуды при пересадке тоже возможна иммунная реакция, которая помешает органу прижиться.
Что же делать? Да просто заменить и кровеносную систему на человеческую! Недавно ученые нашли ген под названием ETV2 — регулятор развития кровеносных сосудов. Если выключить этот ген, у эмбриона не развивается кровеносная система. Значит, можно сделать комплементацию бластоцист и заменить свинье все сосуды на человечьи.
Также авторы того исследования обнаружили одну из возможных причин низкого «уровня химеризма» человеко-свиньи. Когда человеческие клетки оказываются в окружении свиных, они очень любят себя убивать. Настолько им некомфортно. Но некоторые механизмы самоуничтожения можно подавить – и в несколько раз увеличить количество клеток, которые выживают в свинье.
Словом, пока эта технология не доведена до совершенства. Но если ее доработать, это спасет миллионы жизней. Это будут не просто человеческие органы, выращенные в свинье. Это будут кастомные органы, состоящие из клеток конкретного человека, ваши или мои, ровно с такой же ДНК, как у нас. Просто выращенные в животном.
Второй подход: от животных — к людям, с поправками
Этот подход мне кажется самым близким к реализации. Метод заключается в том, чтобы пересаживать людям генетически модифицированные собственные органы животных – в частности, тех же свиней. Это называется ксенотрансплантацией, «пересадкой между видами».
Первая успешная пересадка сердца свиньи человеку случилась в 2022 году. Любопытный факт: свинья была клонирована и генетически модифицирована, чтобы ее сердце лучше подходило для трансплантации человеку. Причем не просто модифицирована, а модифицирована генами человека. В частности, ей вставили гены, которые снижают воспаление и свертываемость крови, чтобы не было тромбов. И выключили несколько генов, которые вызывают особо острый иммунный ответ. Поскольку свиные сердца, в отличие от человеческих, растут всю жизнь, ученым пришлось подавить рецептор гормона роста.
Через месяц после операции мужчина со свиным сердцем восстановился. Но потом что-то пошло не так. И на 60-й день его пришлось отключить от аппарата жизнеобеспечения. Странное наблюдение: на посмертном исследовании выяснилось, что за это время сердце таки увеличилось в весе почти в 2 раза – правда, там были следы чего-то вроде отека. Но не было следов классического отторжения.
Позже была проведена вторая подобная операция. Пациент достаточно быстро пришел в себя, ходил, разговаривал, даже играл в карты с женой. И кстати, будучи сам в некотором роде ученым, с большим интересом наблюдал за ходом восстановления. Но, к сожалению, через полтора месяца скончался, — завещав команде врачей по-максимуму использовать полученный опыт во благо будущих пациентов.
Не известно, от чего именно умерли эти двое. Но в обоих случаях удалось преодолеть самое большое препятствие – иммунное отторжение органа. То же самое касалось еще одной пациентки. Ей пересадили свиную почку.
Тут надо подчеркнуть. Все три пациента изначально были в терминальной стадии болезни. Именно поэтому по правилам им уже нельзя было пересаживать человеческие органы. Еще они принимали кучу лекарств. Наконец, в случае первого ксеносердца – впоследствии в нем обнаружили свиной цитомегаловирус, который мог активироваться после пересадки.
И, тем не менее, эти революционные операции показывают, что человечество еще никогда не было столь близко к бесконечному источнику органов для трансплантации. Да, их еще предстоит активно дорабатывать. Например, самая новая версия свиных почек для пересадки включает 69 разных генетических редактирований. И вряд ли и это предел.
Оптимизма добавляют работы, где сердца и почки свиней пересаживали здоровым бабуинам. Со свиным сердцем бабуин смог прожить 945 дней, с почкой — 260 дней. Еще были работы на макаках-резусах, там одна прожила со свиной почкой больше года.
Так что у человеческих пациентов проблема, вероятно, действительно не в пересаженном органе, а в общем состоянии здоровья. Еще один довод в пользу ЗОЖ: берегите себя на случай непредвиденной ксенотрансплантации.
Но я должен упомянуть и проблемы этого подхода. Одна из вещей, которая все еще вызывает у ученых опасения, — эндогенные ретровирусы, встроенные в ДНК свиней. Они носят общее название PERV – и некоторые их подтипы могут передаваться человеку. Если с обычными вирусами можно бороться с помощью вакцин и проверенных практик животноводства, то с вирусами, которые встроены в ДНК свиньи, так не получится. Но в 2017 ученые уже смогли вырезать такие вирусы из генома свиньи при помощи генетических ножниц CRISPR-Cas9. А затем создать целую линию свиней, у которых они были инактивированы.
Звучит все это сложно. Но вот в чем прелесть: если ты один раз вывел идеальную ГМО-свинью, подходящую для донорства, дальше ты можешь просто ее размножать. А это значит, еще немного — и у нас будут свиные органы по цене свинины.
Третий поход: удивительные органоиды
Третий подход к созданию искусственных органов основан на удивительной способности наших клеток – умении самоорганизовываться в орган.
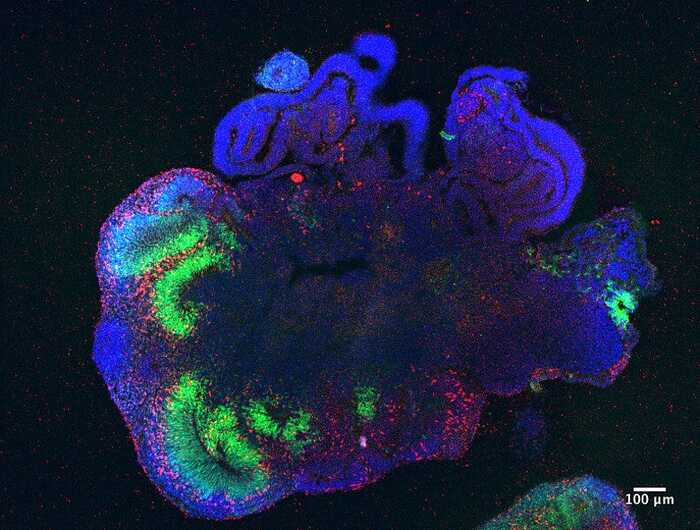
Перед вами мини-орган, мозговой органоид.
Ученые научились выращивать такие органы в пробирке из индуцированных эмбриональных стволовых клеток. Да, это не полноценный орган, порой с неправильной внутренней организацией. Но органоиды могут выполнять некоторые функции «большого брата», а в некоторых случаях практически все. Поэтому на них можно изучать в миниатюре, как орган работает, смотреть, что делает с ним болезнь, испытывать на нем лекарства и генные терапии. И даже попытаться такой органоид пересадить. Что, если получится?
Как ни странно, первыми люди научились делать органоиды именно мозга. Чтобы создать собственный мини-мозг, вам понадобится:
Это проверенный рецепт 2013 года от Юргена Кноблиха и команды ученых из австрийского Института молекулярной биотехнологии. Сначала Кноблих и Ко откатили взрослые клетки человека в эмбриональное состояние факторами Яманаки. Получились плюрипотентные клетки, то есть универсальные, которые можно специализировать в любой другой тип. Из них создали структуру, которая имитировала некоторые аспекты раннего эмбрионального развития.
Дальше их специализировали в предшественники нервных клеток и добавили на капельки матригеля — это такой субстрат для выращивания, который по составу похож на внеклеточный матрикс. Такой клей из различных белков. Все это вместе положили в крутящийся биореактор – и оставили на несколько недель. В итоге там сама собой сформировалась довольно сложная структура, которая отчасти воспроизводила раннее развитие человеческого мозга. В этом крошечном органоиде были участки, похожие на мозговые желудочки, наполненные жидкостью. Была незрелая глазная сетчатка. И даже кусочки защитных оболочек, которые отделяют мозг и череп. И наблюдалась нервная активность в подобии коры.
Орган тут же начал приносить пользу. Например, исследователи создавали органоид мозга и заражали его вирусом Зика. При беременности этот вирус может вызвать у плода микроцефалию — ребенок рождается практически без мозга. И на органоиде ученые смогли точно увидеть, как это происходит. Вирус подавляет нейрогенез, строительство новых нейронов, и так мешает мозгу расти.
Также мини-мозги помогают нам бороться с опухолями мозга, многие из которых почти неизлечимы. Вносим в клетки минимозга мутации с помощью CRISPR-Cas9 и вблизи наблюдаем, как развивается рак, а потом смотрим, что на этот рак действует.
И это еще не все. Уже сейчас есть протоколы, по которым можно создавать органоиды легких, печени, почек, поджелудочной железы, мочевого пузыря и так далее. Тут открывается целое море возможностей. Во-первых, за мини-органами возможное будущее персонализированной медицины. Многие методы лечения одним помогают лучше, а другим хуже, не говоря о побочных эффектах. А тут мы берем у вас клетку, выращиваем несколько ваших же органоидов – и проверяем на них и эффективность, и побочки.
Например, недавно сделали ректальный органоид. То есть имитацию соответствующего участка прямой кишки. И тестировали на нем множество лекарств против муковисцидоза.
Во-вторых, благодаря органоидам можно снизить количество опытов на животных. По сути, тут мы экспериментируем на человеке – но при этом ни люди, ни зверюшки не страдают. В-третьих, некоторые органоиды уже пробуют использовать для пересадки.
Например, создали человеческие органоиды кровеносных сосудов и пересадили их мышам. И сработало. В теле мышек успешно проросли сосуды из человеческих клеток. В том эксперименте хотели получить мышей-химер, чтобы изучать влияние лекарств на человеческие капилляры. Но по идее эти же органоиды можно пересадить и человеку, если у него где-то проблемы с кровоснабжением.
Была еще одна работа, которая меня особо впечатлила. Ученые создали органоиды кишки из клеток мышей – и вкалывали их в поврежденный кишечник другим мышам. Прямо вот… сзади. Некоторые детали этой процедуры довольно стремные, но забавные. Например, сообщается, что «анальная щель была немедленно закупорена гистоакрильным клеем, чтобы фрагменты органоидов оставались внутри».
Клей через три часа удаляли. А через пару недель проявилась и польза. Чужие мини-органоиды улучшили регенерацию в поврежденной кишке. Может, и мы тоже будем вкалывать себе здоровые органоиды, чтобы быстрее восстановился наш больной орган.
А еще одна группа ученых недавно заставила крыс… прозреть. Взяли зверьков с генетическим заболеванием, при котором отмирает сетчатка. Ученые взяли человеческие стволовые клетки, сделали органоиды, подобные сетчатке, и ввели их в глаза крыс. Органоиды успешно прижились, прожили в глазу несколько месяцев и даже начали вырабатывать фоторецепторы. В тестах у крыс улучшилось зрение по сравнению с контрольной группой. Похожие работы сейчас ведутся и на людях, потерявших зрения из-за отказа сетчатки.
А еще сейчас ученые пытаются разработать трансплантируемые органоиды почек. Такие мини-органы выживают после трансплантации в течение нескольких месяцев, у них даже могут образовываться кровеносные сосуды. К сожалению, пока о работоспособной почке речи не идет. И все потому, что органоиды очень маленькие.
Например, относительно недавно ученые сделали самособирающееся человеческое сердце. Этот органоид мог биться, у него были многие важные для работы структуры. Но это мини-сердце достигало лишь 1,5 мм в диаметре. С таким не проживешь.
Четвертый подход: печать органов
Четвёртый подход – это печать органов. Иногда даже с помощью 3D-биопринтера, хотя его участие необязательно. Главное — принцип. Клетка за клеткой, слой за слоем синтезировать весь орган вне тела, готовый к использованию. Самый известный и успешный кейс такой печати – это создание искусственного мочевого пузыря.
У людей с заболеваниями мочевого пузыря брали уротелиальные и мышечные клетки. Далее создавали объемный каркас в форме мочевого пузыря из коллагена и биоразлагаемых полимеров – и высеивали на него эти клетки. Примерно через два месяца все это имплантировали пациентам. Некоторым для улучшения регенерации еще добавляли клеток жировой ткани. И получались прекрасные мочевые пузыри. Правда, они ничего не чувствовали. Отсутствие иннервации — проблема всех таких дизайнерских органов, по крайней мере пока.
Дело в том, что все нервы внутри наших органов – это отростки, которые идут из скоплений нейронов, ганглиев. Все ганглии находятся вне органа, одни прямо возле спинного мозга, другие где-то еще. Как сделать так, чтобы они «дотянулись» до нашего искусственного мочевого пузыря, пока неясно. К счастью, бывают органы, которым иннервация просто не нужна.
Один из них – вилочковая железа, она же тимус. Внутри нее созревают важные Т-клетки, они отвечают за иммунный ответ и помогают нам защищаться от инфекций. И недавно ученым удалось реконструировать работающую мини-версию человеческого тимуса.
Каркас органа сделали из железы мыши. А потом «засеяли» этот каркас человеческими клетками. По сути, получили частично напечатанный искусственный орган. Его вставили в мышей с иммунодефицитом – и он заработал. У мышей начали вырабатываться человеческие иммунные Т-клетки.
Однако нам нужна настоящая 3D-биопечать. Чтобы орган собирался автоматически, с нуля, как деталь в принтере, от каркаса до наполнения. И такой процесс существует. Он похож на обычный 3D-принтинг, когда модель объекта загружают в станок и тот печатает его из клея-пластика. Только в биопринтинге в качестве чернил используются человеческие клетки. Еще к ним добавляют специальный гидрогель из привычной для клеток среды, своего рода «биоклей». Он удерживает нанесенные клетки на месте, а вот игла принтера может в нем двигаться.
И в 2019 году ученые смогли сделать человеческое сердце, используя такие биочернила. Одно чернило — человеческие мышечные клетки. Другое — эпителиальные клетки, которые нужны для формирования кровеносных сосудов. И те, и другие получили с помощью все тех же факторов Яманаки.
С помощью компьютеризированной томографии авторы построили цифровую модель сердца человека. И на 3D-биопринтере напечатали маленький кусочек ткани, который совпадал с частью левого желудочка. Иммунологически, биохимически и анатомически он идеально подходил пациенту. Им буквально можно было бы заменить кусочек сердца – как заплаткой.
А вот создать сердце целиком оказалось гораздо сложнее. Главная проблема и главное ограничение 3D-биопринтинга – вес трехмерного органа. Он слишком велик, чтобы клей-гидрогель мог удержать его при печати. Орган просто разваливается.
Тогда попробовали печатать его внутри плотного желе из полисахаридов и питательных веществ, такого биохолодца. Но даже с этим ухищрением получилось напечатать сердце только размером 20 на 14 мм. Так что пока, к сожалению, это работает только с очень маленькими органами, вроде железы-тимуса.
Вообще большой размер – иногда проблема. Чем крупнее орган, тем сложнее доставить в него питательные вещества во время его сборки. Ведь клетки все время нуждаются в питании. Приходится каким-то образом имитировать сосудистую сеть. Встраивать в модель всякие сосудоподобные микроканалы. Но пока получается не очень. В видео я рассказываю об одном решении, сюда не поместилось.
Вместо заключения
Как видите, мы сильно продвинулись в технологиях создания искусственных органов. Здесь работает синтез самых продвинутых областей генной инженерии, IT-технологий, биомедицины, микроскопии… Мы включаем и выключаем гены, создаем химеры, перепрограммируем клетки, печатаем органы на принтерах. Сложно представить, сколько жизней смогут спасти эти технологии.
Может оказаться, что для каких-то органов лучше подойдет один подход, для каких-то другой. Или мы научимся не только дублировать человеческие органы, но и создавать более совершенные. Пусть и не как у космодесантников из Вархаммера, нафаршированных запасными органами с защитой от ядов. Но зато сможем лечить генетические заболевания и все лучше понимать нашу биологию.
Доживем ли мы до такого будущего? Это зависит от того, насколько человечество будет поддерживать научный прогресс. Прогресс наступит быстрее, если поддерживать науку.
Мой европейский тур стартует 15 февраля с Хельсинки!
В какие города я ещё поеду? См. билеты и инфо здесь.
Подписывайтесь на мои соц. сети