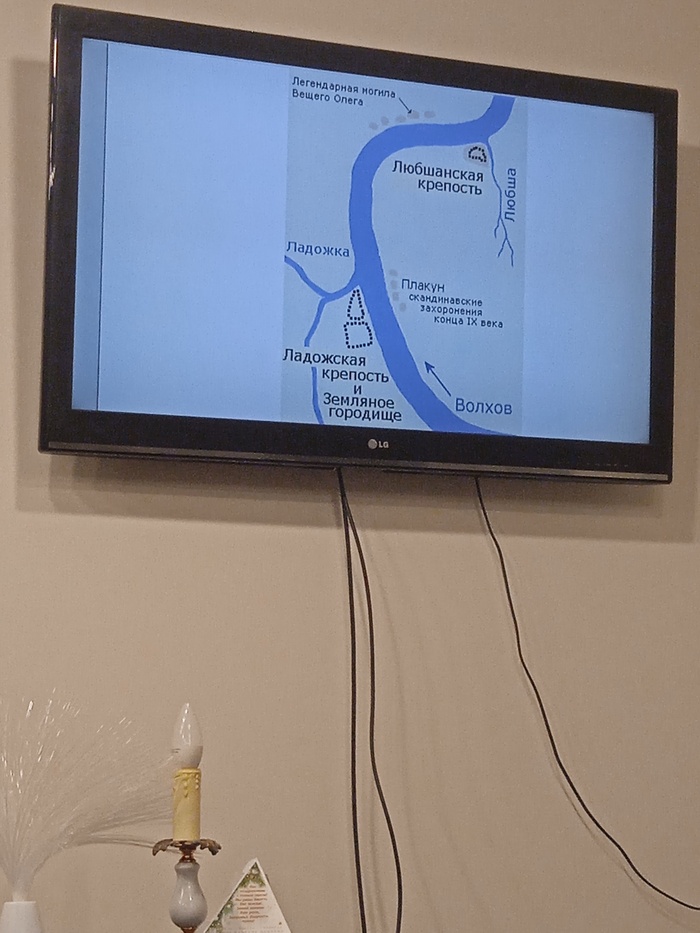
ГенЛикбез №0, aka - Поехали, по генетической терапии
Чем она принципиально отличается от всех других типов лечения, в т.ч. - прочей биотерапии?
Сюрприз: тем, что при этом используются либо плазмиды (они не встраиваются в ДНК клеток, но, проникая в них, заставляют в течение некоторого времени вырабатывать то полезное, что кодируют), либо вирус-векторы: условно-живые структуры, способные "инфицировать" клетку и внедрить в неё несомый ген. Например, кодирующий правильный белок того фактора свёртывания крови, который у данного человека повреждён, что приводит к гемофилии того или иного типа.
Но сначала разберём, какие вообще типы лекарственной терапии бывают?
Намеренно, очень грубыми мазками:
1) Химиопрепараты. Абсолютное большинство известных, и неизвестных, вам лекарств.
Их ещё иногда (и правильно) называют ксенобиотиками - просто потому, что в для организма это - чуждые вещества.
Это направление родом из фитотерапии, химии и связанных тем. Простейший пример - аспирин. Это со сих пор синоним ацетилсалициловой кислоты, а почему? По Байеру) Салицилаты из коры ивы, известного жаропонижающего средства, были выделены ещё в начале 19-го века, и только в его конце было придумано ацетилировать их.
Результатом было получение вещества, которое гораздо лучше растворимо в воде, отлично всасывается из ЖКТ и обладает куда более скромным местно-раздражающим действием, чем сами салицилаты.
Попадая в организм, ацетилсалициловая кислота делает только одно: ингибирует циклооксигеназы, ферменты, отвечающие за синтез некоторых медиаторов воспаления, а также активацию тромбоцитов.
В результате: противовоспалительное, в т.ч. обезболивающее и жаропонижающее, действе, а также уменьшение агрегации тромбоцитов (именно поэтому, малые дозы аспирина по сию пору используются в кардиологии, и будут использоваться, вероятно, всегда).
То есть, этот класс - вещества, химически меняющие что-то в организме. Бесплатно это не бывает, поэтому у каждого препарата есть как показания, так и противопоказания, и побочные действия, и вопросы лекарственной совместимости, и много чего ещё.
2) Ингибиторы или активаторы киназ. По сути, тех или иных клеток в целом. Эта группа промежуточная между первой и третьей, и довольно разнородна. Большинство препаратов этой группы - онкологические, например сорафениб - первый в истории, немного увеличивший продолжительность жизни при первичном раке печени.
В общем, это отдельная, большая история, которой я занимался в первой половине сознательной жизни, и оставил во второй.
Опознать эти лекарства-ингибиторы просто: их международные названия оканчиваются на -nib
Лекарства-активаторы - это, прежде всего, всевозможные факторы роста; о них речь впереди.
3) Моноклональные антитела и подобные им белки (такие, как например этанерцепт). Классика биотерапии!
Это белки, синтезируемые в биореакторах, задача которых: найти свою мишень, и уничтожить её. Первым таким препаратом (1986, Janssen) стал муромонаб: антитело, нацеленное на один из белков поверхности Т-лимфоцитов (гуглим мульт Клетки_за_работой, там разжёвана их функция:).
В результате Т-лимфоциты гибнут, что важно, например, для предотвращения реакции отторжения трансплантата.
Без этих препаратов нельзя представить себе современную онкологию, ревматологию, трансплантологию и ещё несколько областей.
А можно их, наоборот, активировать: препарат ипилимумаб, и некоторые другие. Они связываются а рецепторами-активаторами Т-лимфоцитов - это важно, например, в терапии меланомы.
Ещё один пример: есть такая штука - "фактор некроза опухоли", мощнейший регулятор иммунного ответа.
Его можно ингибировать (тот же этанерцепт или например адалимумаб) - использование в ревматологии, где он избыточен и вреден.
А можно, наоборот, активировать - сейчас это исследуется в онкологии.
Или, другой пример - бевацизумаб, первый в мире инактиватор фактора роста сосудов.
До сих пор сохранил своё место в онко, хотя создаёт свои трудности, поскольку из-за него сосудам сложно расти не только в опухоли (об этом речь впереди).
Изначально эти препараты были, так сказать, "животного происхождения" - мышиные, например. Это вызывало свои трудности: к ним, в свою очередь, вырабатывались антитела, как к чужеродным белкам. По мере развития биотехнологии, количество чужеродных белков в препаратах уменьшалось, в современных - их нет совсем.
Опознать большинство препаратов этой группы также просто: они заканчиваются на -mab.
Есть ещё МАССА всего. Клеточная терапия, лечение живыми организмами, тромбоконцентратом... Всего и не перечесть. Где это по теме к генетической - будем касаться, да.
Вот, а теперь - к, собственно, генетической терапии!
Фуфломицинов не касается, гомеогомы, проходящие мимо - не стесняйтесь, проходите)
Хотели бы стать овощем?
Представьте, что генетики в будущем каким-то образом научатся внедрять механизмы фотосинтеза в людей? Хотели бы питаться энергией солнца?
Подкожный имплантат восстанавливает ощущения. Через оптоволокно и редактирование генов
Для стимуляции конкретных отделов мозга обычно используются нейроимпланты. Для их установки необходимо просверлить часть черепа и установить электроды напрямую в мозг. Но, вместо того чтобы сверлить череп и устанавливать электроды в мозг, можно использовать новое гибкое устройство. Имплант плотно прилегает к поверхности черепа, повторяет его форму и стимулирует участки мозга светом, что проходит сквозь кость. Нюанс – нужно генетически отредактировать нейроны.
Оптогенетика и регенерация
При потере конечностей, протезы могут восстановить функциональные способности. Те же протезы рук, которые сами контролируют силу захвата. Такие протезы безусловно полезны, но они не могут передавать сенсорную информацию о текстуре, влажности и плотности материалов, как это делает наша кожа.
Первое в своем роде оптогенетическое устройство из Северо-Западного университета рядом с Чикаго предлагает альтернативу. Нейроимплант, размером с ключ от дома и тоньше монеты, устраняет необходимость в трепанации черепа. Установка минимально инвазивна, так как устройство вживляется под кожу головы. Хотя, в случае утраченных конечностей, можно восстановить нейронную связь.
Нейробиологи прикладывают мягкий, гибкий «нейро-ключ» к поверхности черепа, откуда сам имплант направляет активирующий нейроны световой луч, непосредственно через череп в кору головного мозга. Буквально хакнув эволюционно развитые сенсорные каналы.
Имплант мозга, оптика и редактирование генома
В готовящейся к публикации научной статье в журнале Nature Neuroscience ученые описывают, как в экспериментах на моделях мозга мышей нейро-ключ точно активировал группы нейронов. Но сами нейроны были модифицированы геном светочувствительных водорослей. Мыши, которые не могли видеть, слышать или чувствовать, быстро научились интерпретировать световые сигналы для выполнения различных задач.
Наш мозг постоянно преобразует электрическую активность в ощущения. А эта технология дает возможность напрямую вмешаться в этот процесс. Имплантируемая платформа позволяет создать совершенно новые тип сигналов, достаточно сильный и конкретный для того, чтобы мозг научился их использовать. Технология приближает нас к восстановлению утраченных чувств после травм или болезней, а также открывает окно в понимание основных принципов, позволяющих нам воспринимать мир.
Руководитель эксперимента Евгения Козоровицкая, профессор нейробиологии.
Для работы оптогенетических имплантатов необходима генетическая модификация нейронов, поэтому они пока не одобрены для использования у человека. В то же время, если говорить про конечности, то можно вживить в остатки нервной ткани специальные магниты. А сами протезы устанавливать «поверх тела», минимально инвазивно для человека.
От улучшения имплантов к регенеративной медицине
Нейро-ключ рассматривается как потенциальный инструмент для людей, потерявших способность видеть, слышать или чувствовать. А именно, работая в паре с устройствами, способными передавать информацию, стимулирующую те же нейроны, которые получают информацию от наших глаз, ушей и кожи.
Это уже потенциал для реабилитации, особенно после неврологических последствий инсульта, а также возможности для более точечного управления роботизированными руками, кистями, ногами и ступнями.
Также технологию можно использовать для облегчения хронической боли. Нейро-ключ может управлять ощущением боли без побочных эффектов и риска привыкания, связанного с опиоидами и системно потребляемыми препаратами, наравне с новыми поколениями обезболивающих.
Светодиоды и стимуляция мозга
В первой статье команда использовала один микро-светодиод. Но уже отмечают, что новый подход с массивом из 64 микро-светодиодов создает практически бесконечное количество паттернов, различающихся по «частоте, интенсивности и временной последовательности». Управление каждым светодиодом в реальном времени позволяет передавать сложные световые паттерны в мозг, чтобы имитировать сенсорный опыт распределенной нейронной активности, а не узкой, локализованной активации.
Разработка этого устройства потребовала от нас переосмысления подхода к доставке направленной стимуляции в мозг в формате, который был бы одновременно минимально инвазивным и полностью имплантируемым. Благодаря интеграции мягкой, гибкой матрицы [до 64] микро-светодиодов, каждый из которых диаметром в человеческий волос, с модулем управления и беспроводным питанием, мы создали систему, которую можно программировать в режиме реального времени. При этом система остается под кожей, без какого-либо заметного влияния на естественное поведение субъектов.
Комментарий ученых.
По словам ученых, конструктивные особенности нейроключа это сам по себе «значительный шаг в создании устройств, которые могут взаимодействовать с мозгом без необходимости использования громоздких проводов или внешнего оборудования», и представляют ценность не только для нейробиологических исследований, но и потенциально могут улучшить здоровье человека.
И традиционно, для тех, кто ищет больше материалов о трансгуманизме, киберпанке, здоровом улучшении и расширении возможностей организма – приглашаю в сообщество Neural Hack. Подписывайтесь, чтобы первыми получать свежие материалы!