Наша справка. Леонард Липович родился в СССР, в г. Ленинграде, в 1976 году, там учился в школе № 160, пока в 1989 году вместе с родителями не эмигрировал в США. Образование завершал уже в Америке – сначала в одной из лучших школ Нью-Йорка, затем – в Корнеллском университете (Cornell University), входящем в Лигу Плюща. Получив степень бакалавра, переехал в Сиэтл, где защитил докторскую степень в университете штата Вашингтон, работая в лаборатории профессора Мэри-Клер Кинг, открывшей первый ген, связанный с возникновением рака молочной железы. С того времени эта тема входит в круг научных интересов Леонарда Липовича. Следующим этапом его карьеры стала четырехлетняя постдокторская стажировка в Сингапуре, посвященная изучению больших некодирующих РНК в стволовых клетках человека. В 2007 году, по возвращению в США, начал работу в Государственном университете Уэйн, сначала на должности младшего профессора, а в настоящее время – в ранге доцента.
– Господин Липович, дайте, пожалуйста, Ваше определение термина «постгеномная медицина».
– Начнём с упрощённого определения прегеномной медицины – это когда, скорее всего, почти ничего не зная об особенностях ДНК пациента и его генетике, мы всем чуть ли не вслепую прописываем одни и те же лекарства - в зависимости только от клинических особенностей болезни - и надеемся, что какому-то проценту пациентов они помогут. Постгеномная медицина началась, когда появилась возможность, во-первых, дёшево и быстро секвенировать геном пациента и, исходя из его уникальных генетических особенностей, в некоторых случаях сразу понять: какие-то лекарства ему помогут, а какие-то применять не стоит. Опираясь на генетические особенности, можно также давать человеку осмысленные индивидуальные профилактические рекомендации по коррекции образа жизни, вырабатывать персональную стратегию сохранения его здоровья.
В дальнейшем же открывается ещё более захватывающая и важная перспектива: разработка персонализированных молекулярных медикаментов, которые уникально и терапевтически взаимодействуют с (например) болезнетворной РНК или белком в клетках пациентов, не затрагивая функцию "здоровых" макромолекул.
А второй аспект – сейчас мы научились не только «читать» геном, но и – потенциально – редактировать его, что открывает принципиально новые возможности.
– Насколько я понимаю, к идее редактирования генома человека многие относятся настороженно.
– Я скажу больше, существует международный мораторий на конкретные типы таких манипуляций, в частности в зародышевых клетках, поддержанный большинством стран мира. Сразу скажу: редактирование генома не входит в мою область работы, и в моей лаборатории эта технология не употребляется, поэтому могу только коротко прокомментировать. Но на лечение некоторых генетических дефектов в соматических клетках мораторий не распространяется, и там главное сейчас – понять, как процедура редактирования может повлиять на другие гены, а не на тот, который является мишенью. И только когда угроза возможных побочных эфектов будет достоверно снята, можно ожидать и введения этой технологии в клиническую практику.
– В своем докладе Вы подчеркнули, что сейчас надо сосредоточить внимание не только на ДНК, но и на РНК. Для чего это нужно?
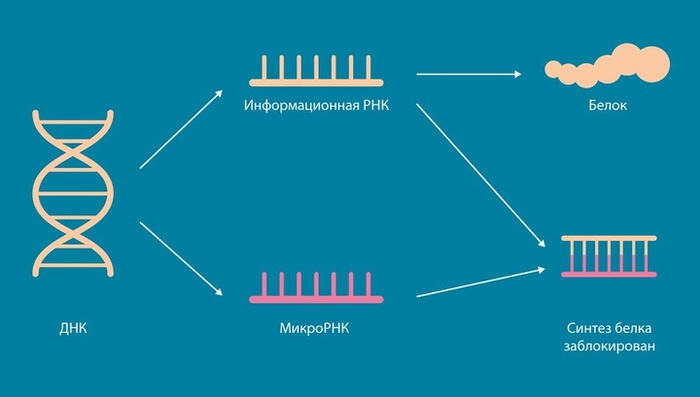
– Начиная с середины прошлого века долгое время считалось, что главное в клетках – это ДНК (как носитель нашей наследственности) и белки, из которых фактически и состоит клетка. РНК же отводилась роль служебного звена в цепи синтеза белка – всего-навсего промежуточного носителя информации на пути от ДНК к рибосомам, и не более. Это так называемая «Центральная догма молекулярной биологии».
Но после завершения секвенирования генома человека, в начале нашего века, ученые поняли, что результаты не подтвердили «догму»: в клетке содержится очень много РНК и большая ее часть не задействована в синтезе какого-то белка. Эти РНК просто существуют. Но, очевидно, что всё это не может быть обычным клеточным мусором, а микро-РНК и другие короткие некодирующие РНК являются относительно малой частью транскриптома, значит, у хоть какой-то части остальных, "больших некодирующих" РНК могут быть свои функции. Начался поиск этих функций, я участвовал в этом процессе в период моей стажировки в Сингапуре. Мы поняли, что отдельные некодирующие РНК решают в клетке задачи, которые никак не связаны с рибосомами и синтезом белка. Зато функционирование некоторых из них связано с сохранением особенностей стволовых клеток, а также с такими болезнями, как рак и диабет. Обнаружение этой связи стало нашим вкладом в изучение роли РНК. И, собственно, является одной из причин, по которой они заслуживают более пристального внимания.
– И что именно Вам и Вашим коллегам удалось выяснить?
– Во-первых, мы обнаружили, что многие большие некодирующие РНК человека примато-специфичны. Они есть у человека, у обезьян и способны вызывать у нас болезни. Но у других организмов (не относящихся к приматам) этих конкретных РНК нет. Зато есть, у мышей например, совершенно иные РНК, без эволюционных эквивалентов за пределами грызунов.
– Получается, что их нельзя изучать на традиционных лабораторных животных?
– Мы изучаем их на культурах человеческих клеток. Одни культуры используются для определения роли онкогенных и антиопухолевых РНК в раке молочной железы, другие – первичные клетки печени, гепатоциты – для исследования связи между такими РНК и развитием диабета. Мы можем подавлять или, наоборот, активировать отдельные гены и наблюдать за клеточными фенотипами. А потом думать, как эти клеточные фенотипы взаимодействуют с фенотипами всего организма.
– То есть, когда мы говорим о генетических корнях того или иного заболевания, неправильно сосредотачиваться только на ДНК?
– Именно так. Конечно, ДНК анализировать необходимо, но главная загвоздка здесь вот в чем – нужно правильно интерпретировать результаты этого анализа. Многие годы многие мои коллеги шли по такому пути: сравнивали ДНК больных людей и здоровых, обращали внимание на какой-то полиморфизм, который чаще присутствует у одной группы и реже у второй. Затем просто искали ближайший белковый ген, правда, он мог находится очень далеко от исходного полиморфизма, на расстоянии десятков, а то и сотен тысяч нуклеотидов в цепочке ДНК. И, несмотря на это, они брали его за главный объект, рассматривали его как возможную причину предрасположенности к заболеванию. Мы отрицаем такой подход к анализу полиморфизмов за пределами белковых генов и пользуемся ручной аннотацией данных от консорциумов ENCODE и FANTOM, в которых мы непосредственно участвовали. И на основе этих данных выявили, что некоторые эти полиморфизмы находятся внутри генов больших некодирующих РНК, а другие – в междугенных регуляторных элементах вблизи таких генов. И сейчас мы анализируем роль, которую играют эти гены. В частности, мы выяснили, что в клетке иногда рибосомы делают ошибки, и по открытым рамкам считывания этих больших РНК синтезируются короткие пептиды. Теперь мы хотим понять, что эти пептиды делают в клетке, может быть, они как-то связаны с патогенезом рака или с автоиммунными ответами и т.д. Поэтому мы планируем, чисто в качестве эксперимента (поясняю, это не клинические планы работы), с помощью технологии CRISPR-Cas устранить эти ошибки, то есть сами РНК останутся, но синтез таких пептидов по ним станет невозможным. Тогда мы сможем сравнить фенотип клеток с этими пептидами и без них.
– В области Ваших научных интересов уже есть какие-то прикладные подходы или пока это фундаментальная наука в чистом виде?
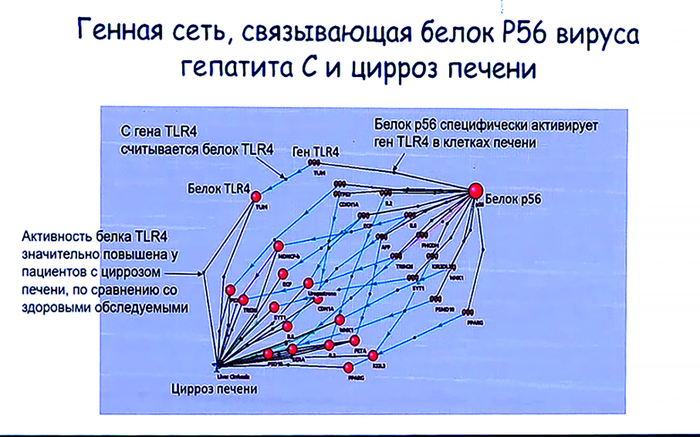
– Несомненно, есть, и я кратко описал их в своем докладе. Например, искусственные короткие РНК могут являться терапевтическими агентами, если знать, транскрипт какого гена нужно подавлять. Для этого они вводятся с помощью инъекции в организм, поступают в итоге в печень пациента и там подавляют свои мишени. Это было на практике доказано несколько лет назад датской компанией Santaris. Они поняли, что инфицирование человека вирусом гепатита С возможно потому, что геномная РНК вируса взаимодействует с одной конкретной клеточной микроРНК печени человека. Причем, эта микроРНК не имеет критического значения для жизни человека, в печени есть ее аналоги.
Идея датских ученых заключалась в том, чтобы подавить ее активность и тогда вирусу будет не с чем связываться, не будет его репродукции. Клинические испытания прошли удачно, но затем акции этой компании выкупила другая структура, и очевидно, приостановила эти исследования, а тем временем на рынке появились новые антивирусные лекарства (но не на основе РНК) против гепатита С, эффективные, хотя и дорогостоящие.
Мы же сейчас развиваем и в будущем с клиническими или индустриальными партнёрами хотим применить аналогичный метод в лечении диабета. Нами найдена и уже функционально подтверждена, на основе экспериментов на гепатоцитах, длинная некодирующая РНК, ген-кандидат, который активен только в клетках печени. И мы тоже хотим подавить его с помощью комплементарной искусственной короткой РНК, чтобы вылечить тех людей, у которых есть полиморфизм этой РНК, ассоциированный с данной болезнью. Работа эта продолжается и вскоре результаты первого этапа ее будут опубликованы, тогда о них можно будет говорить подробнее.
– Если говорить не о Вашей группе, а в целом о данном направлении, какие важнейшие задачи сейчас стоят перед мировой наукой?
– В области изучения некодирующих РНК человека и млекопитающих вообще сегодня есть две большие задачи. Первая – разрешить окончательно вопрос о том, участвуют все-таки в процессе кодирования белков все РНК или только часть из них. До сих пор существуют разные точки зрения по этому поводу. Я думаю, разрешить сомнения можно будет – помимо рассмотрения сцепления рибосом с некодирующими РНК, – используя метод прямого масс-спектрометрического анализа, о котором, кстати, много говорилось на этой конференции. Только поняв истинную роль всех РНК, мы сможем двигаться дальше. Второй важный момент. Мы были одной из первых групп, которые доказали, что большинство этих некодирующих РНК примато-специфичны. И для меня это не только научный, но даже философский вопрос: делают ли эти РНК приматов приматами, а человека – человеком. Мы часто изучаем сходство разных видов. Но являются ли такие РНК – новшество в эволюции – прямой причиной различия этих видов?
– По Вашему мнению, исходя из того, как развивается научный процесс, можно ожидать какой-то революции в медицине в ближайшее десятилетие?
– Когда геном человека был опубликован впервые в "черновом" варианте весной 2001 года, я был студентом и как раз выступал с обзорным докладом о нашумевших статьях в Science и Nature на эту тему; помню, обещали, что уже лет через пять постгеномная медицина станет реальностью. Прошло уже семнадцать лет и что мы видим? Кроме чисто диагностического и профилактического прогресса и отдельных, пока что ещё очень редких и дорогостоящих прецедентов, помогающих пока что ничтожно малому количеству пациентов в некоторых конкретных и редких группах, никакого широкого применения постгеномной медицины сейчас и в ближайшие годы я не вижу, врачи так же назначают лечение «вслепую», западные страховые компании не то что за постгеномную медицину, даже за секвенирование генома пациента часто не хотят платить. И чем глубже ученые погружаются в анализ секвенированных геномов, тем больше новых вопросов перед нами встает. Надо признать, мы еще плохо понимаем, как использовать геномные данные для лечения болезней. Мы слишком просто интерпретируем геном, упрощаем очень сложную информацию, например упускаем из виду большие некодирующие РНК и их роль в процессах возникновения болезней. Но я оптимист, верю, что мы поймем эти сложные процессы и тогда потенциал постгеномной медицины будет реализован. Просто произойдет это не так быстро, как хотелось бы.
Оригинал