Лекарство против болезни Альцгеймера
Такую чудесную новость увидела вчера по французскому ТВ, прошу прощения за упоротое фото. Лекарство скоро будет доступно. Укол каждые две недели. К сожалению я не успела ухватить другие подробности, сообщения в новостях увидела уже к концу, но я очень счастлива. Часто работаю в отделении с дементными стариками, какая это всё таки ужасная болезнь.
Препарат от Альцгеймера ускорил снижение когнитивных способностей
Самые смелые исследования порой приводят к неоднозначным результатам. Так и новый препарат, которым проверяли «железную» теорию Альцгеймера, внезапно поспособствовал снижению когнитивных навыков, вместо улучшения защиты мозга.
Хотя все больше данных свидетельствуют о наличии связи между уровнем железа в крови и развитием болезни Альцгеймера, новое исследование, посвященное эффектам доступного препарата, снижающего уровень железа, вызывает опасения относительно использования для лечения этого заболевания.
Железо, мозг, Альцгеймер
С возрастом отложения железа в различных областях мозга могут нарушать когнитивные функции. Исследования показали, что железо играет роль в развитии болезни Альцгеймера, а его избыточный уровень способствует отложению бета-амилоида и образованию Тау-клубков в мозге, способствующих нейродегенерации. Хотя, как показывает практика, тау-клубки на самом деле могут наоборот – помогать мозгу справиться с болезнью
Однако ученые уже обратили внимание на лекарства, которые снижают избыток железа путем хелатирования. В них видели потенциальные методы лечения болезни Альцгеймера. Однако новое исследование, изучающее влияние одного конкретного лекарства-хелатора железа на прогрессирование болезни Альцгеймера, вызвало тревогу.
Исследование стало результатом сотрудничества австралийских учреждений, включая Институт неврологии и психического здоровья Флори (The Florey), Мельбурнский университет, Университет Нового Южного Уэльса (UNSW), Университет Монаша, Университет Кертина, Квинслендский институт мозга, Организацию Содружества научных и промышленных исследований (CSIRO) и Университет Ньюкасла.
Хелатор железа и Альцгеймер
Исследователи изучали препарат Деферипрон, хелатор железа, который обычно используется для удаления избытка железа у людей с определенными заболеваниями крови – талассемия или серповидноклеточная анемия. К ним относятся и люди, у которых слишком много железа из-за повторных переливаний крови.
12-месячное клиническое исследование проводилось на 81 пациенте старше 54 лет с легкими когнитивными нарушениями или ранней болезнью Альцгеймера и подтвержденными отложениями амилоида. Участники были рандомизированы для получения либо 15 мг/кг перорального деферипрона два раза в день, либо плацебо. Первичным результатом было улучшение когнитивных функций — памяти, исполнительных функций и внимания. Их исследователи оценивали на исходном уровне, через 6 и 12 месяцев. Вторичные результаты включали изменение уровня железа в мозге.
МРТ показала, что по сравнению с пациентами из группы плацебо, у пациентов, получавших деферипрон, наблюдалось снижение уровня железа в гиппокампе, области мозга, которая активно участвует в памяти. Однако, хоть препарат и снижал уровень железа в мозге, у пациентов наблюдалось ускоренное снижение когнитивных способностей в целом, вызванное в первую очередь ухудшением результатов в тестах на исполнительные функции. Исполнительные функции — это термин, обозначающий высшие умственные процессы, которые позволяют нам строить планы, концентрировать внимание, запоминать и совмещать несколько задач.
Фактически, результаты испытаний свидетельствуют о том, что снижение уровня железа с помощью деферипрона ухудшает состояние людей с болезнью Альцгеймера.
Больше материалов про мозг, необычные стороны повсеместно используемых препаратов, сознание и его природу – вы найдете в сообществе. Подписывайтесь, чтобы не пропускать свежие материалы!
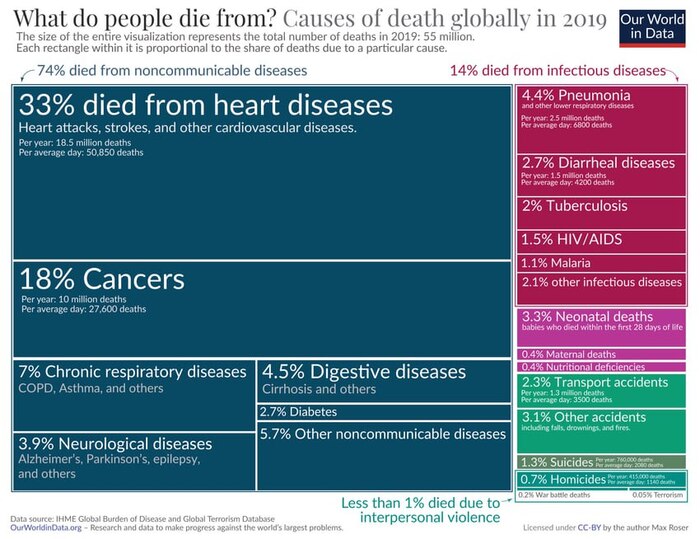
От чего умирают люди? Данные за 2019 год
Графика на английском, поэтому продублирую некоторые пункты на понятном языке:
33% - от сердечных заболеваний
18% - рак
3.9% - неврологические заболевания (Альцгеймер, Паркинсон и т.д.)
2.7% - диарейные заболевания
2.5% - ВИЧ/СПИД
2.3% - ДТП
И всего 0.05% умирают от террористов.
Забыл
ПЭТ-МРТ и поиск нейродегенеративных заболеваний на ранних стадиях
Диагностические возможности отделения рентгенологических и радионуклидных методов диагностики Центра мозга (https://clck.ru/34f5k9) считаются одними из лучших в России. Среди них - выявление с помощью уникального аппарата ПЭТ-МРТ нейродегенеративных заболеваний (болезнь Альцгеймера и Паркинсона, разнообразные виды деменциии и др.) на самых ранних этапах, невозможное с помощью обычных МРТ и КТ.
Тау-белок, Альцгеймер и пересмотр концепции
Новое исследование в какой-то степени реабилитирует тау-белки, которые ассоциировались с развитием болезни Альцгеймера. Оказывается, что здоровая форма этого белка играет роль «хорошего парня», помогая защищать мозг от вредных свободных радикалов и способствуя здоровому старению.
Сложность биотехнологий в том, что концепции пересматриваются едва ли не постоянно. И то, что было панацеей вчера, сегодня объявляется едва ли не страшнейшим ядом. Управлять такими флуктуациями невозможно, но можно держать руку на пульсе новостей. Больше материалов про мозг, сознание и психику – как всегда, в нашем сообществе. Подписывайтесь, чтобы не пропускать свежие статьи!
Тау-белок и Альцгеймер
Некоторое время назад тау-белок считался причиной болезни Альцгеймера. Исследователи постоянно находили связь между болезнью Альцгеймера, и некоторыми другими неврологическими заболеваниями, с токсичными накоплениями, называемыми тау-клубками, белками в нейронах мозга. Следовательно, основное внимание уделялось разработке методов устранения этих патологических клубков.
Однако новое исследование, проведенное совместно учеными из Медицинского колледжа Бейлора (BCM) и Неврологического исследовательского института Дункана (Duncan NRI) при Детской больнице Техаса, отчасти реабилитировало тау-белок, обнаружив, что он играет роль «хорошего парня», защищая мозг от вредных активных форм кислорода (ROS) и способствуя здоровому старению.
ROS — это естественные побочные продукты различных клеточных функций в организме. Хотя низкие уровни ROS полезны, избыток ROS вреден для клеток, поскольку запускает производство токсичных форм других молекул, которые вызывают окислительный стресс, включая перекисные липиды.
Доктор Линдси Гудман, ведущий автор исследования.
Кислород, его метаболиты и окислительный стресс
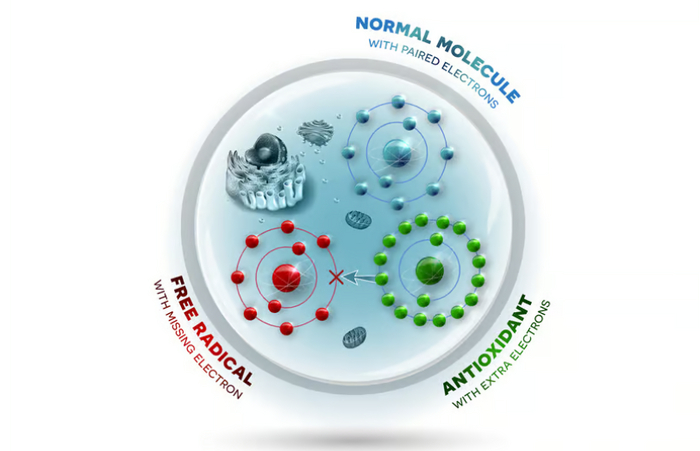
Диаграмма, показывающая, как антиоксиданты взаимодействуют с нестабильными свободными радикалами, заменяя потерянный электрон.
Нейронам для работы требуется значительное количество кислорода, поэтому многие ноотропы работают с тонусом сосудов для нормализации кровотока. Метаболизм кислорода создает нестабильные молекулы – «свободные радикалы», одна из форм которых известна как ROS. В здоровых количествах они поддерживают рост мозговых клеток и когнитивные функции. Но они нестабильны, потому что имеют нечетное число электронов. Антиоксиданты нейтрализуют свободные радикалы, отдавая один из своих электронов, стабилизируя ROS и уменьшая наносимый ими ущерб.
Окислительный стресс возникает, когда есть дисбаланс между производством и накоплением ROS в клетках. Длительный окислительный стресс повреждает клетки мозга и содержащиеся в них белки, жиры и ДНК, что способствует старению и запускает развитие таких состояний, как рак, диабет и болезнь Паркинсона. Перекисное окисление липидов — это процесс, который вызывает ухудшение ROS, и при средних или высоких показателях становится токсичным для организма.
От окислительного стресса к Альцгеймеру и Тау белкам
В 2015 году группа ученых из лаборатории Беллена обнаружила, что нейроны экспортируют эти токсичные перекисные липиды в соседние глиальные клетки — клетки, которые поддерживают структуру нейронных связей и передают нейронам питательные вещества, а также очищают среду от мертвых клеток. Из токсичных перекрестных липидов, глиальные клетки формируют липидные капли, которые хранятся во время бодрствования и преобразуются в энергию во время сна для поддержания нормального функционирования нейронов.
Этот процесс эффективно удаляет и нейтрализует токсичные липиды. В текущем исследовании мы изучили роль тау в формировании глиальных липидных капель.
Доктор Линдси Гудман, ведущий автор исследования.
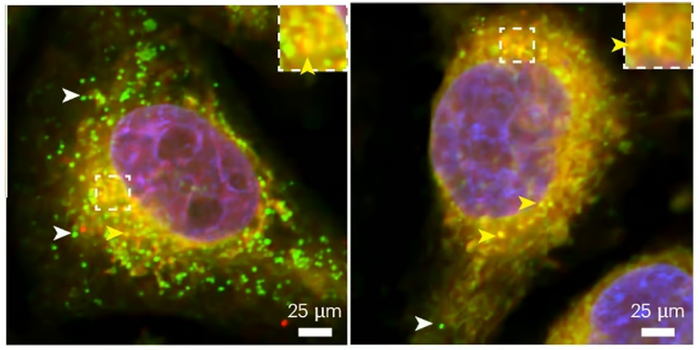
Проводя эксперименты на плодовых мушках Дрозофилах, исследователи обнаружили, что глиальным клеткам требуется нормальный, естественно вырабатываемый тау для формирования липидных капель и защиты от нейронных ROS. Они также обнаружили, что глиальным клеткам, в организмах разных видов, требуются тау-белки для формирования липидных капель.
Потеря тау нарушает почкование липидных капель. Белые стрелки указывают на зрелые капли, которые успешно отпочковались от клетки. Желтые стрелки указывают на будущие капли, которым необходимо отпочковаться, чтобы стать зрелыми.
Плохие и хорошие тау-белки. И их роль при болезни Альцгеймера
Ученые экспериментировали с введением нормального человеческого тау-белка в организм мушек дрозофил, которые были выведены с дефицитом этого белка. И глиальные клетки мушек начали уверенно создавать липидные капли. И закономерно, когда исследователи ввели человеческий тау с мутациями, связанными с повышенным риском болезни Альцгеймера, глия оказалась неспособной формировать липидные капли в ответ на нейрональные ROS.
Это говорит о том, что мутации в тау-белке могут снижать нормальную способность белка предотвращать окислительный стресс, а также приводят к накоплению белка в рамках типичных признаков заболевания, как описано в предыдущей работе.
Доктор Линдси Гудман, ведущий автор исследования.
Когда исследователи использовали крыс и плодовых мушек в качестве моделей тауопатий, которые вызывают повышенную экспрессию человеческого белка тау, то снова наблюдали нарушения в формировании глиальных липидных капель и разрушение глиальных клеток в ответ на нейрональные ROS. Похоже, что в случае с тау действует принцип баланса: дефицит Тау белков так же вреден, как и их избыток. И напрямую влияет на работу сознания.
Исследователи утверждают, что результаты исследования открывают путь к разработке новых способов лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера.
Выявив удивительную новую нейропротекторную роль тау, исследование открывает дверь к потенциальным новым стратегиям замедления, обращения вспять и лечения нейродегенеративных заболеваний.
Доктор Хьюго Беллен, руководитель лаборатории молекулярной и человеческой генетики BCM, соавтор.
Как всегда, больше странных материалов про мозг, психику и сознание вы найдете в нашем сообществе. Подписывайтесь, чтобы не пропустить свежие статьи!