Как работает иммунная система, лекция 2 ч. 14 (ч. 23)
КАК ВРОЖДЕННАЯ ИММУННАЯ СИСТЕМА СПРАВЛЯЕТСЯ С ВИРУСАМИ
Когда вирус заражает человеческую клетку, он захватывает механизм клетки и использует его для производства еще большего количества копий вируса. В конце концов, вновь созданные вирусы вырываются из зараженной клетки и продолжают заражать другие клетки по соседству. Мы уже обсуждали некоторые виды оружия, которые врожденная система может использовать для защиты от вирусов, пока они находятся вне клеток. Например, белки системы комплемента могут опсонизировать вирусы для фагоцитоза макрофагами и нейтрофилами, а белки комплемента могут уничтожать некоторые вирусы. Однако, как только вирус проникает в клетку, чтобы начать свой репродуктивный цикл, это оружие неэффективно.
Система интерферона
К счастью, есть и другое врожденное системное оружие, которое полезно против зараженных вирусом клеток. Действительно, врожденное системное оружие, которого вирусы боятся больше всего, — это система интерферона. Эта защита настолько мощна, что большинство вирусов разработали способы, чтобы попытаться отбиться от системы интерферона – по крайней мере, достаточно долго, чтобы вирус размножился и распространился на нового хозяина.
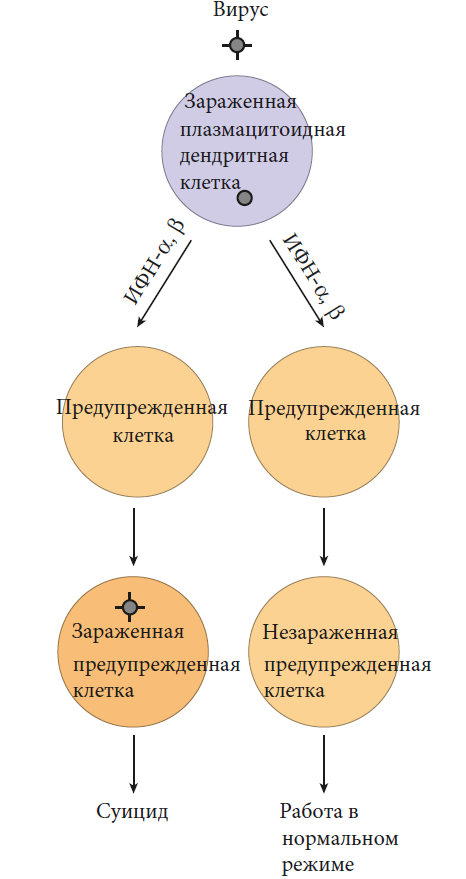
Когда рецепторы распознавания образов обнаруживают вирусную атаку, клетки могут вырабатывать “предупреждающие белки”, называемые интерфероном альфа (ИФН-α) и интерфероном бета (ИФН-β) – белки, которые могут “интерферировать”, т. е. мешать размножению вируса. ИФН-α и ИФН-β называются интерферонами типа I, чтобы отличить их от ИФН-γ, упомянутого ранее, который относится к типу II. Большинство человеческих клеток быстро продуцируют интерфероны типа I, когда на них нападает вирус, и на их поверхности есть рецепторы для этих белков интерферона. Следовательно, интерферон, продуцируемый этими клетками, может фактически связываться с рецепторами на самой инфицированной клетке. Это связывание может привести к образованию нескольких сотен противовирусных белков, которые действуют, чтобы уменьшить количество вируса, продуцируемого инфекцией. Еще лучше, когда интерфероны типа I, продуцируемые инфицированными вирусом клетками, связываются с рецепторами интерферона на соседних клетках, эти клетки предупреждаются о том, что в этом районе есть вирусы и что они могут вскоре подвергнуться атаке. В результате этого предупрежденные клетки включают экспрессию противовирусных генов и готовятся совершить самоубийство, если вирус действительно заразит их.
Элегантная часть системы предупреждения об интерфероне заключается в том, что, хотя связывание интерферона с его рецепторами подготавливает неинфицированную клетку к вирусной атаке, эта клетка продолжает работать как обычно, если только атака на самом деле не происходит. Предупрежденная клетка совершит самоубийство только в том случае, если она заражена вирусом. Конечно, для клетки это альтруистический акт – потому что и клетка, и вирус умирают вместе. Тем не менее, это “благотворное самоубийство” предотвращает размножение вируса и заражение других клеток. И если атака не происходит, предупрежденная клетка в конечном итоге “выходит” из состояния готовности.
Хотя многие типы клеток могут производить интерфероны типа I, “Королем интерферона” на сегодняшний день служит лейкоцит, называемый плазмацитоидной дендритной клеткой (pDC). Человеческие pDC используют TLR7 и TLR9 для обнаружения вирусной РНК и ДНК, соответственно, и когда задействован любой из этих рецепторов распознавания образов, pDC посвящают более половины своей способности производить белки для производства интерферона. В результате плазмацитоидная дендритная клетка может вырабатывать в 1000 раз больше интерферона I типа в день, чем любой другой тип клеток! Следовательно, эти “фабрики интерферонов” могут играть решающую роль в защите врожденной системы от вирусов, особенно на ранних стадиях вирусной инфекции.
Перевод книги LAUREN SOMPAYRAC "HOW THE IMMUNE SYSTEM WORKS", продолжение следует.