Как работает иммунная система, лекция 4 ч. 2 (ч. 39)
ПРЕЗЕНТАЦИЯ АНТИГЕНА МОЛЕКУЛАМИ ГКГ КЛАССА I
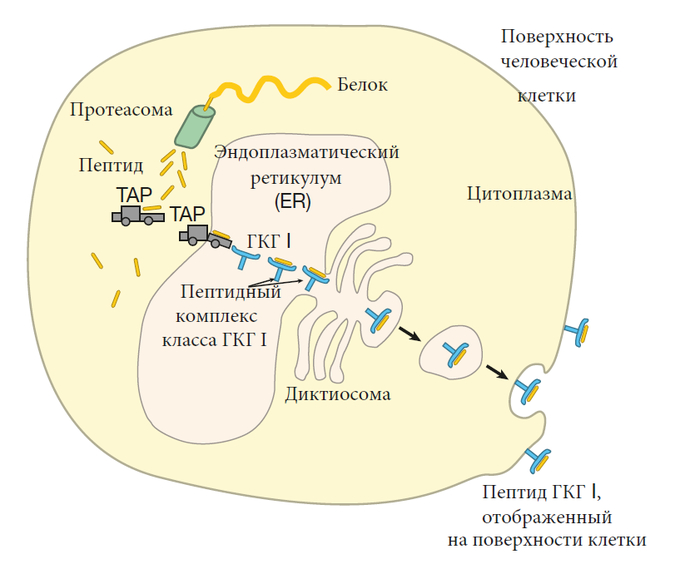
Молекулы ГКГ класса I — это рекламные щиты, которые отображают на поверхности клетки фрагменты белков, вырабатываемых этой клеткой. Иммунологи называют их эндогенными белками. Они включают обычные клеточные белки, такие как ферменты и структурные белки, а также белки, кодируемые вирусами и другими паразитами, которые могли заразить клетку. Например, когда вирус проникает в клетку, он использует клеточный биосинтетический механизм для производства белков, кодируемых вирусными генами. Образец этих вирусных белков затем отображается молекулами ГКГ класса I вместе с образцами всех нормальных клеточных белков. Таким образом, рекламные щиты ГКГ I рекламируют образец всех белков, которые вырабатываются внутри клетки. Почти каждая клетка человеческого организма экспрессирует молекулы класса I на своей поверхности, хотя количество молекул варьируется от клетки к клетке. Т-клетки-киллеры (также называемые цитотоксическими лимфоцитами или CTL) проверяют фрагменты белка, отображаемые молекулами ГКГ класса I. Следовательно, почти каждая клетка представляет собой “открытую книгу”, которую можно проверить с помощью CTL, чтобы определить, была ли она заражена вирусом или другим паразитом и должна ли быть уничтожена. Типичная человеческая клетка содержит на своей поверхности около 100 000 молекул класса I, и после того, как они пробыли там около суток, рекламные щиты ГКГ заменяются новыми – таким образом, отображение ГКГ класса I поддерживается в актуальном состоянии.
Способ, которым эндогенные белки обрабатываются и загружаются в молекулы ГКГ класса I, очень интересен. Когда мРНК транслируется в белок в цитоплазме клетки, часто совершаются ошибки. Эти ошибки могут привести к образованию бесполезных белков, которые неправильно сворачиваются. Кроме того, белки подвергаются повреждениям из-за нормального износа. Поэтому, чтобы убедиться, что наши клетки не заполняются дефектными белками, старые или бесполезные белки быстро поступают в разрушающие белки “машины” в цитоплазме, которые функционируют скорее как измельчители. Эти белковые измельчители называются протеасомами, и они разрезают белки на пептиды. Большинство из этих пептидов затем расщепляются на отдельные аминокислоты, которые повторно используются для создания новых белков. Однако некоторые из пептидов, создаваемых протеасомами, переносятся специфическими транспортными белками (TAP1 и TAP2) через мембрану эндоплазматического ретикулума (ER). Эндоплазматический ретикулум – это большая мешкообразная структура внутри клетки, из которой выходит большинство белков, предназначенных для транспортировки на поверхность клетки.
Оказавшись внутри эндоплазматического ретикулума некоторые пептиды выбираются для загрузки в канавки молекул ГКГ класса I. Я говорю “некоторые”, потому что, как мы уже обсуждали, не все пептиды подойдут. Для начала, пептид должен быть правильной длины – около девяти аминокислот. Кроме того, аминокислоты на концах пептида должны быть совместимы с якорными аминокислотами, которые выстилают концы канавки молекулы ГКГ. Очевидно, что не все пептиды, подготовленные протеасомой, будут обладать этими характеристиками, а те, которые этого не делают, разлагаются или отправляются обратно из ЭР в цитоплазму. Как только молекулы ГКГ класса I загружаются пептидами, они направляются на поверхность клетки для отображения. Таким образом, существует три основных этапа подготовки отображения класса I: генерация пептида протеасомой, транспортировка пептида в эндоплазматический ретикулум с помощью переносчиков TAP и связывание пептида с канавкой молекулы ГКГ I.
В “обычных” клетках, таких как клетки печени и клетки сердца, основная функция протеасом состоит в том, чтобы бороться с дефектными белками. Итак, как вы можете себе представить, измельчители в этих клетках не слишком разборчивы в том, как разрезаются белки – они просто рубят напропалую. В результате некоторые из пептидов будут подходящими для презентации ГКГ, но большинство из них не будут. Напротив, в таких клетках, как макрофаги, которые специализируются на представлении антигена, это расщепление не столь случайно. Например, связывание ИФН-γ с рецепторами на поверхности макрофага повышает экспрессию трех белков, называемых LMP2, LMP7 и MECL1. Эти белки заменяют три “исходных” белка, которые служат частью нормального механизма протеасом. Результат этой замены — “настроенные” протеасомы теперь предпочтительно разрезают белки после гидрофобных или основных аминокислот. Почему, спросите вы? Потому что молекулы TAP-транспортера и ГКГ I отдают предпочтение пептидам, которые имеют либо гидрофобные, либо основные C-концы. Таким образом, в антигенпредставляющих клетках стандартные протеасомы модифицируются таким образом, чтобы они производили изготовленные на заказ пептиды, тем самым повышая эффективность отображения класса I.
Важной особенностью этой системы “измельчи и представь” служит то, что большинство белков, измельченных протеасомами, это недавно созданные белки, у которых есть структурные недостатки, а не старые, изношенные белки. Следовательно, большинство пептидов, отображаемых молекулами ГКГ класса I, получены из недавно синтезированных белков, что позволяет иммунной системе быстро реагировать на инфекцию.
Перевод книги LAUREN SOMPAYRAC "HOW THE IMMUNE SYSTEM WORKS", продолжение следует.