Как работает иммунная система, лекция 3 ч. 4 (ч. 31)
КАК АКТИВИРУЮТСЯ В-КЛЕТКИ
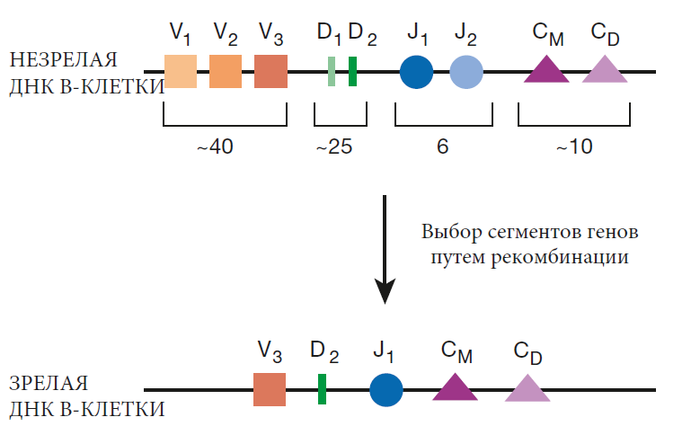
Для выработки антител сначала необходимо активировать В-клетки. В-клетки, которые никогда не активировались при столкновении со своим родственным антигеном, называются наивными или девственными В-клетками. Примером может служить В-клетка, которая может распознавать вирус оспы, но которая, как оказалось, находится у человека, который никогда не подвергался воздействию оспы. Напротив, В-клетки, которые столкнулись со своим родственным антигеном и были активированы, называются опытными В-клетками. Существует два способа активации наивных В-клеток для защиты от вредителей. Один полностью зависит от помощи Т-клеток помощников (активация зависимая от Т-клеток), а второй более или менее независим от помощи Т-клеток (активация независимая от Т-клеток).
Активация зависимая от Т-клеток
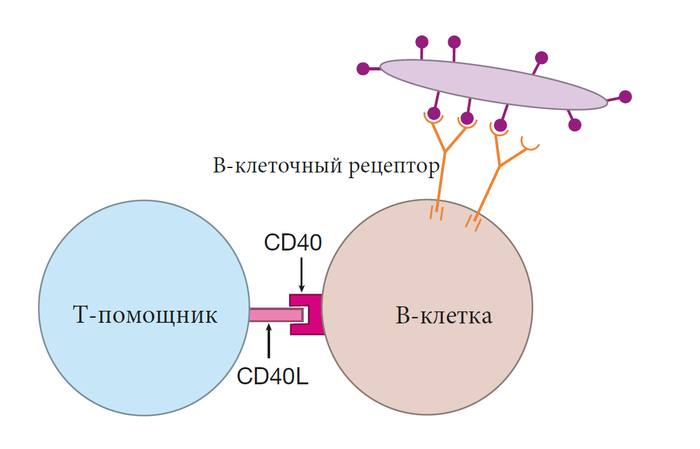
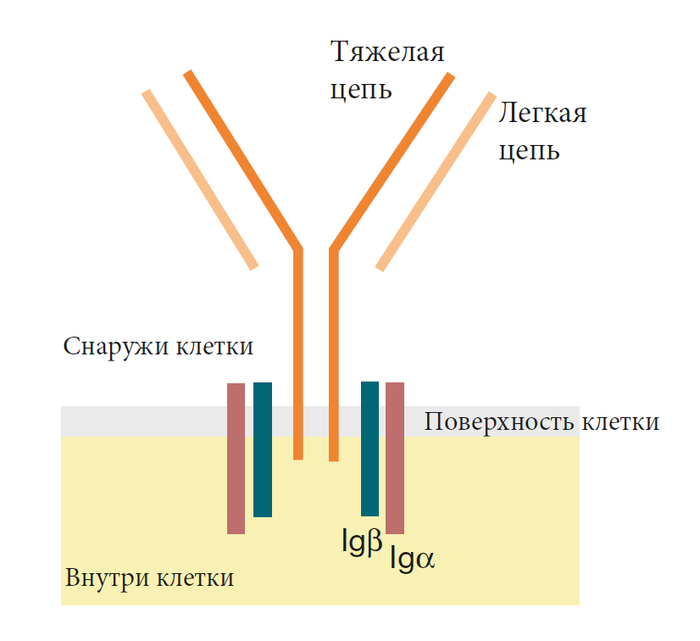
Для активации наивной В-клетки требуется два сигнала. Первый — это группирование рецепторов В-клеток и связанных с ними сигнальных молекул. Однако простого сшивания его рецепторов недостаточно для полной активации В-клетки – требуется второй сигнал. Он называется костимулирующим сигналом. При активации зависимой от Т-клеток, этот второй сигнал подается вспомогательной Т-клеткой (Т-помощником). Наиболее изученный костимулирующий сигнал включает прямой контакт между В-клеткой и Т-помощником. На поверхности активированных Т-клеток-помощников находятся белки, называемые CD40L. Если рецепторы В-клетки сшиты, и если CD40L подключается (лигирует) к белку, называемому CD40, на поверхности В-клетки, эта В-клетка будет активирована.
Взаимодействие между этими двумя белками, CD40 и CD40L, очевидно, очень важно для активации В-клеток. Люди, у которых есть генетический дефект в любом из этих белков, не способны создать защиту антител зависимую от Т-клеток.
Активация независимая от Т-клеток
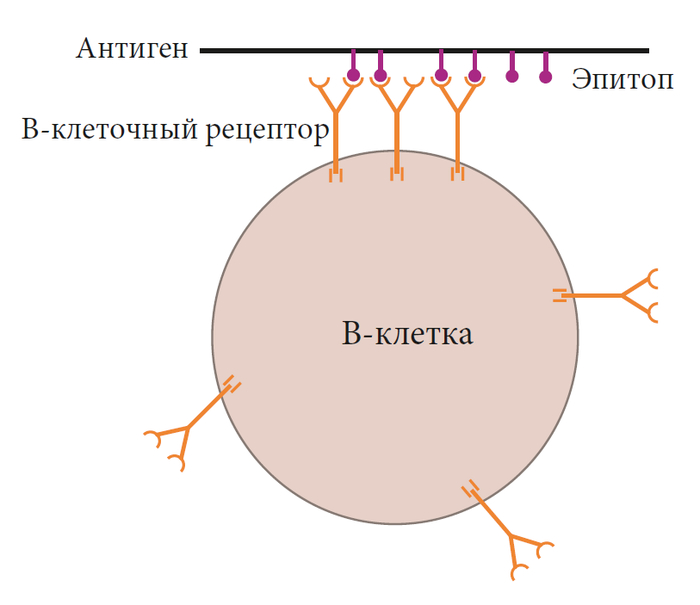
В ответ на определенные антигены девственные В-клетки также могут активироваться практически без помощи Т-клеток. Что общего у этих антигенов, так это то, что у них есть повторяющиеся эпитопы, которые могут связывать тонну рецепторов В-клеток. Хорошим примером такого антигена служит углевод, который содержится на поверхности многих бактериальных клеток. Молекула углеводов состоит из множества повторяющихся единиц, подобно бусинкам на нитке. Если каждую “бусинку” распознает рецептор В-клеток как его эпитоп, нитка бусин может объединить огромное количество рецепторов В-клеток. Сшивание такого большого количества рецепторов В-клеток может частично заменить костимуляцию CD40L и может вызвать размножение В-клеток. Но чтобы быть полностью активированной и вырабатывать антитела, наивная В-клетка должна получить второй сигнал.
Второй сигнал — это сигнал опасности, четкое указанием на то, что началась атака. Например, в дополнение к их рецепторам В-клетки, В-клетки экспрессируют Toll-подобные рецепторы, и эти TLR могут предупреждать В-клетку об опасности и предоставлять второй сигнал необходимый для независимой от Т-клеток активации. Здесь важно то, что если у В-клетки есть рецепторы, которые могут распознавать молекулу с повторяющимися эпитопами, такими как, например, ваша собственная ДНК, В-клетка может размножаться, но, к счастью, антитела против ДНК не будут вырабатываться. Причина в том, что ваша иммунная система не участвует в битве с вашей собственной ДНК, поэтому не будет никаких сигналов опасности для обеспечения необходимой совместной костимуляции. С другой стороны, если врожденная иммунная система борется с бактериальной инфекцией, а рецепторы В-клеток распознают карбогидратный антиген с повторяющимися эпитопами на поверхности бактериального вредителя, эта В–клетка будет вырабатывать антитела, потому что сигналы опасности с поля битвы могут предоставить второй сигнал, необходимый для полной активации В-клеток. Конечно, как и в случае активации зависимой от Т-клеток, независимая активация специфична для антигена: активируются только те В-клетки, рецепторы которых распознают повторяющийся эпитоп.
Одно из преимуществ активации независимой от Т-клеток — В-клетки могут сразу броситься в бой, не дожидаясь активации Т-клеток помощников. Соответственно более быстрая реакция антител. Большинство В-клеток, которые активируются без помощи Т-клеток, находятся в селезенке. Эти “беспомощные” В-клетки могут быстро защитить от бактерий, таких как Streptococcus pneumoniae (стрептококковая пневмония), вырабатывая антитела IgM, которые распознают эпитопы на полисахаридной капсуле, окружающей бактерию. Важность этой независимой от Т-клеток активации подтверждается тем фактом, что люди, у которых удалены селезенки, подвергаются высокому риску заражения стрептококковой пневмонией и другими инкапсулированными бактериями.
Здесь происходит еще кое-что важное. Т-помощники распознают только белковые антигены – пептиды, представленные молекулами ГКГ класса II. Следовательно, если бы для активации всех В-клеток требовалась помощь Т-клеток, вся приобретенная иммунная система была бы сосредоточена на белках. Это не очень хорошо, потому что у многих обычных вредителей на поверхности есть углеводы или жиры, которых нет на поверхности человеческих клеток. Поэтому эти углеводы и жиры служат отличными мишенями для распознавания иммунной системой. Таким образом, разрешение некоторым антигенам активировать В-клетки без помощи Т-клеток - замечательная вещь: это увеличивает количество антигенов, на которые приобретенная иммунная система может реагировать, включая не только белки, но также углеводы и жиры.
Логика активации В-клеток
Вы можете спросить: почему для активации В-клеток требуется два сигнала? Разве все не пошло бы быстрее, если бы единственным условием было сшивание рецепторов? Да, это, вероятно, ускорило бы выработку антител, но это также было бы слишком опасно. Из-за разнообразия рецепторов В-клеток практически нет ограничений на то, что они могут распознавать – включая наши собственные белки, углеводы и жиры. Большинство В-клеток, которые могут распознавать наши собственные молекулы, удаляются вскоре после того, как они рождаются в костном мозге (подробнее об этом в лекции 9). Однако этот процесс обнаружения не на 100% эффективен, и в циркуляции находятся самореактивные В-клетки, которые могут вызвать аутоиммунное заболевание, если они продуцируют антитела (аутоантитела). Для защиты от такой возможности существует безотказный механизм, который позволяет активировать В-клетки только при наличии реальной опасности. Вот тут-то и поступает второй сигнал. Для зависимой активации В-клетка и Т-клетка должны понять, что существует угроза. Для независимой активации второй сигнал служит четким указанием на то, что произошло вторжение – опасная ситуация, которая требует активации В-клеток.
Поликлональная активация
В дополнение к активациям В-клеток зависимым и независимым от Т-клеток существует “неестественный” способ активации В-клеток. В этом случае антиген, обычно называемый митогеном, связывается с молекулами на поверхности В-клеток, которые не служат рецепторами В-клеток, и объединяет эти молекулы. Когда это происходит, рецепторы В-клетки, которые связаны с этими молекулами, также могут группироваться. В отличие от зависимой и независимой активации, поликлональная активация не зависит от родственного антигена. Таким образом, множество различных В-клеток с различными особенностями могут быть активированы одним митогеном. Действительно, митогены — излюбленные инструменты иммунологов, потому что их можно использовать для одновременной активации множества В-клеток, что облегчает изучение событий, происходящих во время активации.
Одним из примеров митогена служит структура с высоким содержанием повторяющихся последовательностей, которая составляет поверхность некоторых паразитов. Во время паразитарной инфекции молекулы, составляющие эти структуры, могут связываться с рецепторами (митогеновыми рецепторами) на поверхности В-клеток и объединять их в кластеры. И когда рецепторы митогена группируются таким образом, рецепторы В-клеток также группируются вместе. В результате происходит поликлональная активация В-клеток. Но почему иммунная система должна реагировать на паразитарную атаку, активируя В-клетки, чьи рецепторы даже не распознают паразита? Ответ в том, что это не то, для чего была создана иммунная система! Активируя группу В–клеток, которые будут вырабатывать ненужные антитела, паразит стремится отвлечь иммунную систему от сосредоточения на текущей работе — уничтожении паразитического вредителя. Таким образом, поликлональная активация В-клеток митогеном на самом деле служит примером того, что иммунная система ошиблась – тема, которую мы подробно обсудим в другой лекции.
Перевод книги LAUREN SOMPAYRAC "HOW THE IMMUNE SYSTEM WORKS", продолжение следует.