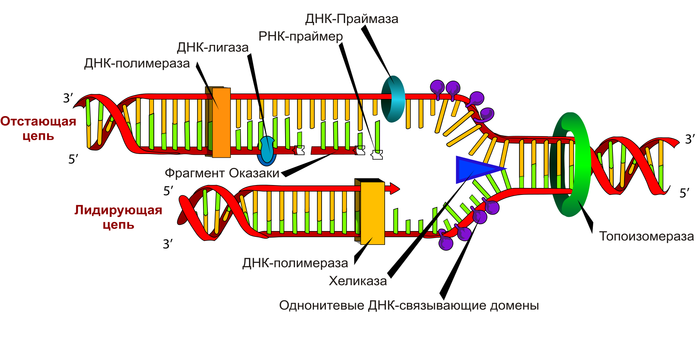
Я молекулярный биолог и достаточно давно работаю с векторами. Поэтому я решил рассказать как устроена Ad5 и Ad26 (Ad 2/6) двухкомпонентная векторная вакцина от COVID-19 (Спутник-5). Официальной информации по вакцине достаточно мало, кроме того, что она векторная и двухкомпонетная, что для большинства людей мало что проясняет. Для начала разберёмся что же такое вектор АД он же Ad он же AAV вектором является аденовирус (или адено-ассоцированный вирус, что сути не меняет). Аденовирусов в природе существует множество, практически все многоклеточные организмы от человека до простейших имеют аденовирусы которые могут заражать их клетки. У людей аденовирусы вызывают респираторные и кишечные заболевания, Вы скорее всего с ними сталкивались.
Причем тут аденовирусы?
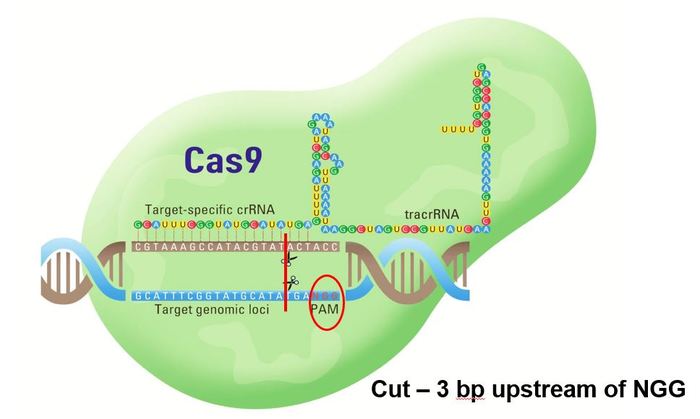
Всё дело в том, что генетический код аденовируса изучен и его можно модифицировать, например взять код который кодирует некий белок (белок может быть любым, медузы, змеи, насекомого, полностью синтетический), главное знать его генетический код. Вставим этот код в правильное место в коде вируса, чтобы не нарушить целостность синтаксиса (программисты меня поймут). Код вируса, это генетическая программа достаточно короткая и простая (по сравнению с многоклеточными организмами или тем более человеком) и каждый белок и, соотвественно, функция вируса закодирована в генетическом коде. Теперь когда клетки заражаются таким таким генно-модифицированным аденовирусом они производят белок который мы закодировали. Мы так же не хотим, чтобы наш модифицированный аденовирус самостоятельно размножался, так как при этом он может взывать заболевание сам по себе, а так же может мутировать с непредсказуемыми последствиями, поэтому мы благоразумно вырежем участок кода, отвественный за разможение вируса. Такой модифицированный вирус называется вектором, он заражает клетки и прозводит в этих клетках нужный нам протеин, это называется трансдукция.
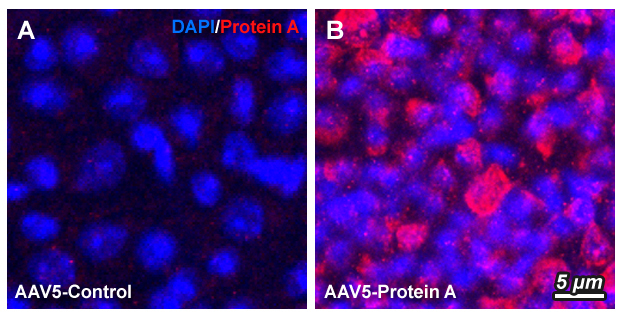
(A) Сетчатка мыши трансдукция контрольным вектором. (B) Сетчатка мыши трансдукция вектором с протеином А. Протеин А (красный сигнал), контрокрашивание ядер DAPI.
Например на этой иллюстрации я собрал вектор на основе АД5 (тот же самый что и в первом компоненте Спутник-5, Вы ведь уже догадались, что цифра 5 в названии вакцины, это от сборки на АД5?) и ввёл сборку в глаза двух мышей 1 микролитр около 1x10^8 копий вектора, (А) одной мыши я ввёл пустой вектор без кода протеина А (это котрольный эсперимент), второй (B) с кодом протеина А. После 5 недель ожидания я извлёк глаза у мышей и попытался обнаружить протеин А в сетчатке с помощью флоуресцентых антител к протеину А. Ядра клеток окрашены DAPI (вещество которые при соединении с ДНК светится в ультрафиолете). Как видите, в сетчатке мыши которой ввели пуcтой вектор сигнал отсуствует и только ДНК в ядрах светится синим, в то же время, мышь которой ввели вектор с кодом протеина А демонстрирует красное свечение в множестве клеток, что указывает, что протеин А в них присуствует, такой метод исследования называется иммунофлуоресцентный анализ или МФА. Производство протеина сохраняется пока живы клетки, зачастую несколько месяцев и даже лет. Клетки вектор не убивает, так как у него остуствует функция разможения. Над разными версиями векторов работают множество лабораторий, обычно их можно приобрести готовыми к рекомбинации (сборке) с кодом нужного белка.
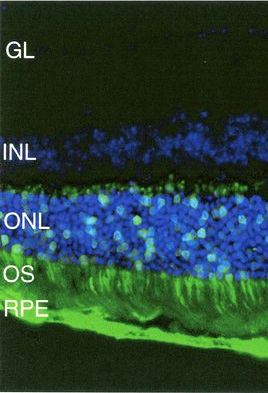
На этой фотография зелёный флоурецентный протен (GFP) с помощью вектора ввели в глаз мыши, а затем выполнили гистологические срезы (глаз поместили в криогель, заморозили и выполнили тончайшие срезы, пригодные для наблюдения под микроскопом). Зелёные клетки сетчатки трансдуцированы (заражены) вектором, производят GFP и светятся зелёным. Это одна из первых научных статей о доставке и трансдукции протеина в сетчатке глаза. Yang и соавторы. https://jvi.asm.org/content/76/15/7651 Слои сетчатки: GL - Ганглиозный слой, INL – внутренний нуклеарный слой, ONL - внешний нуклеарный слой, OS - Внешние сегменты фоторецепторов, RPE - Пигментный эпителий сетчатки.
Кстати код протеина GFP выделен из медузы Aequorea victoria и за это в 2008 году группе учёных совершивших это открытие была присуждена Нобелевская премимя по химии, но это совсем другая история.
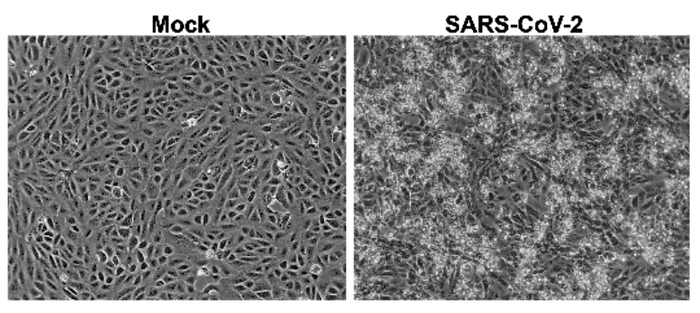
Фазово-контрастная фотография здоровой культуры клеток Vero (слева) и после заражения COVID-19 (справа). Белые сгустки - погибшие клетки. Vero - культура клеток почечного эпителия африканской зелёной обезьяны. https://www.biorxiv.org/content/10.1101/2020.03.02.972927v1
Опять же, это всё интересно, но какое это имеет отношение к вакцине от COVID-19?
Когда человек заражается COVID-19 в его клетках формируются копии COVID-19 вируса, на них реагирует имунная система и производит антитела, которые в сочетании с другими клетками имунной системы в конечном счёте уничтожают вирус и человек поправляется. Человек переболевший COVID-19 сохраняет иммунитет к повторному заражению некоторое время. Его кровь соддержит антитела и может быть использована в лечебных целях у других заболевших. Проблема в том, что производство антител достаточно медленный процесс, зачастую имунная система просто не успевает и человек погибает от COVID-19 инфекции раньше, чем производство антител набирает обороты (количество антител называется титром). Когда вы болели обычным Гриппом (Influenza) основные симптомы сохраняются около недели иногда и дольше пока имунная система распознает белки вируса и отрабатывает производство антител до достаточного для выздоровления титра. Для разных заболеваний этот процесс занимает разное время.
Помните протеин А, который я произвёл в клетках мыши и потом окрасил антителами? Как эти антитела к протеину А получили? Кролику ввели протеин А, его имунная система отреагировала на присуствие чужеродоного протеина А и затем из сыворотки крови кролика эти антитела отфильтровали, смешали с красным флоуресцентным красителем (примерно тем же как в маркерах для обводки текста) и таким образом я смог получить снимок. Собственно технически кролика вакцинировали протеином А. Есть и другие способы производства антител, но это выходит за рамки этой статьи.
Значит если человку ввести белки COVID-19, но не сам вирус COVID-19 у него появится иммунитет и он не заболеет?
Именно так! Имунная система хорошо распознает вирусные белки, следовательно если выделить белки COVID-19 и ввести человеку, то у него развётся иммунитет. Выделять чистый белок вируса в больших количествах к тому же так, чтобы его не повредить и он сохранил свои свойства для имунной реакции достаточно сложный и дорогой процесс, а вакцины нужно много. Гораздо проще ввести код протеинов COVID-19 в аденовирусный вектор и клетки человека трансдуцированные (заражённые) вектором сами произведут нужный протеин на который отреагирует имунная система. При соотвествующем оборудовании и клетках векторы копируются легко и дёшево в больших количествах. Другой важный момент, векторы производят белок в трансдуцированных клетках на протяжении всей жизни клетки, месяцы, иногда годы после трансдукции, таким образом способствуя длительному сохранению иммунитета. Авторы вакцины сообщают о стойком имунитете длительностью более года.
Теперь давайте разберёмся какой именно протеин закодирован в векторах АД5 и АД26 вакцины Спутник-5.
Взгляните на эту фотографию COVID-19, сделанную электронным микроскопом (вирус невозможно увидеть в световой микроскоп, поскольку он меньше длинны волны света). Однако электроны намного меньше вируса и позволяют получать изображения отдельных вирусов и их структуры. На фотографии (А) вы видите, что поверхность вируса COVID-19 (круглые объекты похожие на картофелины), усеяна пиками (Spike) (B, C, D) этот белок помогает вирусу COVID-19 прикрепляться к клеткам и заражать их. Многие коронавирусы имеют такие пики, собственно поэтому их именно так и назвали из-за внешнего вида на электронной фотографии. Из прошлых исследований коронавирусов, включая тяжёлый острый респираторный синдром (SARS) мы уже знаем, что эти пики вызывают наиболее активное выделение антител и собственно разработка вакцины для SARS так же была основана на основе белков пик, к сожалнию, структура белков SARS и COVID-19 немного отличается, поэтому вакцина от SARS не эффективна против COVID-19.
На английском языке всё очень хорошо и понятно о моллекулярной структуре spike protein изложено вот в этой статье, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7151553/.
(A) Сканирующая электронная фотография COVID-19. (B) Увеличенный фрагмент снимка А. (С) Увеличенная контрастность и размеры отдельной пики (spike). (D) Трехмерная модель структуры Spike protein. https://www.biorxiv.org/content/10.1101/2020.03.02.972927v1
Вирус COVID-19 вырастили в культуре клеток, выделили вирусную РНК и считали генетический код COVID-19 с помощью РНК сиквенса. Затем в коде выделили фрагмент отвечающий за производства протеинов пик. Вписали фрагмент этого кода в аденовирусный вектор. Теперь при введении человеку вектора в его клетках будут производится фрагменты пик COVID-19. Обратите внимание только один протеин, и то не целиком, а только иммунопродуцирующий фрагмент, полноценный вирус COVID-19 при этом никак собраться не может, так как генетическому коду для его сборки просто неоткуда взяться. Поэтому заболеть COVID-19 через аденовирсный вектор невозможно. Теперь у нас есть человек, в клетках которого, производятся белок пик COVID-19, его имунная система распознаёт присуствие чужеродного белка пик и начинает производство антител без заболевания.
Почему вакцина двухкомпонентная?
АД5 более подвержен воздействию имунной системы, потому, что помимо антител к протеинам пик, так же вырабатываются антитела с самому АД5. Поэтому после первичного имунного ответа спустя 3-5 недель вводится второй компонент, тот же самый код пик COVID-19 в упаковке АД26, этот вектор меньше подвержен воздействиую имунной системы и производит большее количество протеинов пик. К тому же после взаимодействия с протеинами пик доставленных вектром АД5 уровень антител уже существует и имунный ответ будет более быстрым и стойким (многие вакцины например от Гепатита Б двух или трёхкомпонентные и так же построены на векторах). В резульате мы получили иммунитет к COVID-19. Если теперь уже настоящий COVID-19 попадёт в иммунизированный организм, к протеинам пик COVID-19 немедленно присоединятся антитела которые сформировались против синтетического протеина пик (они идентичные) имунные клетки уничтожат вирус помеченный антителами и вы никогда не поймёте, что несколько часов в вашем теле присутствовал COVID-19. Это и является иммунитетом.
Если это так просто, почему вакцина появилась только сейчас?
Просто это в теории. Требуются длительные эксперименты, чтобы собрать рабочий вектор, убедится что вектор производит нужные белки. В ответ на иньекцию вектора производятся антитела у лабораторных животных. Затем заразить лабораторных животных COVID-19 и убедится что у них развился иммунитет. Произвести исследования на предмет каких либо осложнений у животных. Затем провести эксперименты на добровольцах и убедится в безопасности сборки, всё это требует времени и ресурсов.
Насколько это безопасно?
В целом безопасно, как я уже писал выше абсолютно невозможно заболеть COVID-19 получив векторную вакцину, просто потому, что она соддержит единственный протеин пик и то, его фрагмент, полному вирусу собраться неоткуда. Заболеть аденовирусной инфекцией тоже незвозможно, так как участки кода, отвественные за копирование аденовируса в АД5 и АД26 отсуствуют. С аденовирусами ваш организм за свою жизнь сталкивался множество раз. Возможно кратковременное повышение температуры после введения вакцины, как реакцию организма на присуствие АД5 или АД26. Если вы раньше болели аденовирсной инфекцией краткое повышение температуры можно ожидать уже от АД5. Если нет, то скорее всего повышение температуры будет иметь место после иньекции АД26, так как начальная иммунизация АД5 уже произошла. Наличие крайне малого количества фрагмента протеина пик в вашем организме никакого вреда не несёт. Присуствует так же небольшой риск острой аллергической рекции к АД5 и АД26, но такой же риск существует у любой другой вакцины, употреблении любой пищи или любого препарата. Последний тип осложенений так же крайне маловероятный - риск аутоимунных реакций, он минимален в связи с тем что белки пик COVID-19 чужеродны человеческому организму (это как раз хорошо, было бы очень плохо если они походили например на белки сердечного клапана или клеток поджелуждочный железы, тогда бы заражение COVID-19 вызвало заодно и аутоимунный перекардит или панкреатит, смертность была бы намного выше, а разработка вакцины заняла бы намного большее время, а этого, как вы знаете, не произошло), поэтому риск что антитела сформировавшися против белков COVID-19 могут по ошибке атаковать здоровые человеческие ткани маловероятен.
Если COVID-19 в будущем мутирует означает ли, что вакцина перестанет от него защищать?
Да, Вы правы. Если такая мутация произойдет, то потребуется разработка новой вакцины. Собственно COVID-19 мутирует постоянно, однако эти измнения незначительны с иммунологической точки зрения. Потребуется фундаментальное изменение структуры вируса, что происходит редко и такие мутации не всегда жизнеспособны. Например потеря или значительное измение структуры протеинов пик, так же вероятно, уменьшит и способность вируса к заражению, так как пики используются для прикрепления вируса к клеткам. На сегодняшний день протеин пик идентичен для всех на известных серотипов (мутаций) COVID-19.
Насколько было оправданно внедрить векторную вакцину сразу после стадии клинических испытаний II (несколько сотен добровольцев) без полномасштабных клинических исследований стадии III (несколько тысяч)?
В США для борьбы с COVID-19 правительством был досрочно одобрен к применению у больных COVID-19 препарат chloroquine, эффективность которого в отношении COVID-19 не была достоверно доказана и впоследствии ислледования подтвердили, его низкую эффективность, поэтому препарат был отозван и более при COVID-19 не применяется). В то же время Спутник-5 достоверно вызвает имунный ответ и устойчивость к заражению COVID-19, что было подтвержденно на стадии I и II клинических испытаний, работа над клиническими исследованиями стадии III уже проводится, но вакцина, вероятно, будет доступна населению РФ до завершения стадии III. Как биолог, в целом я считаю такое решение оправданным риском.
По своей архитектуре вакцина сравнительно безопасна, АД5 и АД26 используются в научной работе, генной терапии и во множестве других вакцин по всему миру. По сути 90% кода вакцины это давно проверенный код вектров АД5 и АД26 с включением фрагмента протеина пик по которому была проведена серьёзная научная работа. В то же время существует опасное заболевание COVID-19 которое уже унесло жизни миллионов человек по всему миру и каждый день эта цифра увеличивается. Скорейшая вакцинация населения страны и прекращение эпидемии имеет так же крайне важный социально-экономический аспект.
Стоит ли мне вакцинироваться от COVID-19 вакциной Спутник-5?
Решение получить вакцину от COVID-19 или нет остаётся за вами, я бы только хотел, чтобы это было осознанное решение, с пониманием, что это такое и какие биологические процессы произойдут в вашем организме после введения Спутник-5. Я надеюсь, что эта статья помогла вам.
Примечание 1: Я не имею отношения к научной группе участвовашей в разработке вакцины Спутник-5. Значительная часть информации основана на моём опыте работы с АД5 и АД26 векторах и основных принципах трансдукции, генной терапии, разработки вакцин, иммунологии и вирусологии. Если у вас есть дополнительная информация по Спутник-5 или коррекции по данному тексту, пожалуйста отпишитесь в комментариях.
Примечание 2: Я старался писать этот материал максимально доступным языком, но если вам что-то непонятно, дайте знать, я попробую объяснить подробнее.
Примечание 3: Статья Lui и соавторов "Viral Architecture of SARS-CoV-2 with Post-Fusion Spike Revealed by Cryo-EM" https://www.biorxiv.org/content/10.1101/2020.03.02.972927v1 из которой представленны фазово-контрастные фотографии здоровой культуры Vero и заражённой COVID-19, а так же электронные микрофотографии COVID-19 и Spike protein находится в стадии Preprint и ещё не прошла академическое рецензирование. В то же время я счёл фотографии достаточно наглядными и достоверными для включения их в этот материал.
Примечание 4: Если после прочтения материала вам все равно ничего не понятно, пожалуйста ознакомьтесь с упрощённым переводом материала от @Zerokko на Пикабушный язык #comment_177412091
"Вы взяли давно и хорошо изученный аденовирус (ОРВИ или что-то подобное), отрезали у него хер с яйцами, чтобы он не мог размножаться в организме. Потом вы отрезали причиндалы у коронавируса и пришили их к аденовирусу вместо отрезанных. Т.к. хер у аденовируса чужой, тот не то что оплодотворить никого не способен, у него вообще не стоит. И вот, подплывает этот вирус со своим вялым членом к здоровой клетке, пытается её поиметь, а нихрена не получается. Клетка орёт, ей на помощь приходят антитела, вирусу дают люлей, его хер фоткают, и теперь, когда в организм проникает Ковидка, его по причиндалам узнают и сразу дубасят. Антитела и на сам Ковид всё равно бы среагировали, но он бы успел трахнуть много клеток, родилось бы ещё больше ублюдков, и был бы тяжелый ущерб организму.".
Примечание 5:
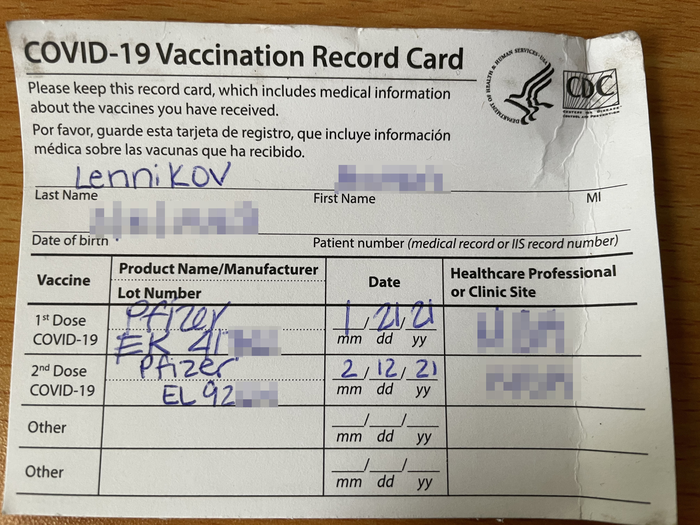
После публикации мне не раз задавали вопрос. "А вы сами то будите вакцинироваться?" Теперь у меня есть на него ответ. Я получил вакцину Pfizer две дозы. Я бы предпочёл Спутник-5 так как она вызывает меньше побочных эффектов, но на моей территории она недоступна. Первая доза вызвала лёгкий дискомфорт в месте укола, но в целом прошла для меня незамеченной. Вторая доза вызвала повышение температуры, озноб, головную боль, тошноту около 2 дней. Уровень симптомов как при сильной простуде (без кашля или заложенности носа) если бы не выходные я бы взял больничный. Симптомы ослабли и полностью исчезли, теперь я защищён от COVID-19. И могу посещать публичные места не опасаясь тяжёлой болезни или смерти, носить маску по социальным причинам, а не из страха заражения. Насколько я знаю, Спутник-5 вызвает схожие или меньше симптомы при применении.