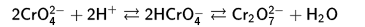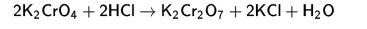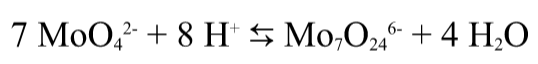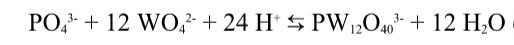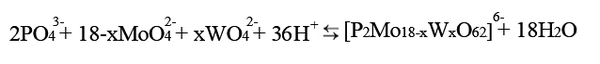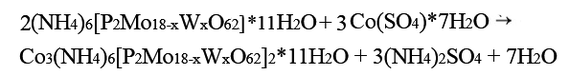Серия «Рассказы о химии»
Драгоценный металл XIX века
В 1820-х годах один датский физик выделил ранее неизвестный металл. Он обладал уникальными свойствами; низкая плотность, пластичность, высокая теплопроводность и коэффициент отражения, а также стойкость к коррозии, поскольку поверхность моментально покрывалась твердой пленкой оксида. Главным недостатком являлось трудоемкость его получения: воздействие на его соль металлическим калием или натрием, растворенным в ртути, с последующим её удалением.
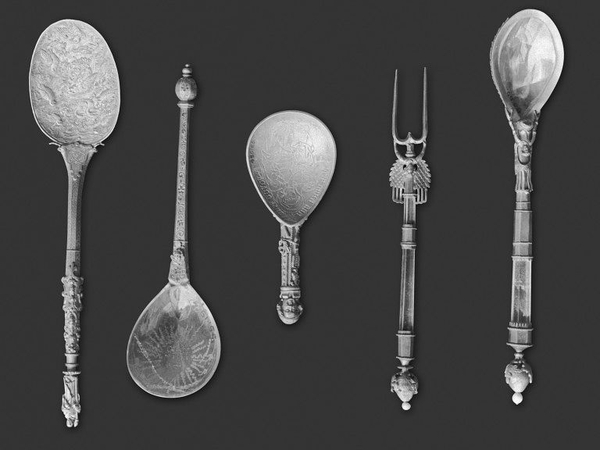
Спустя пару десятков лет новым металлом особенно заинтересовалась Франция, а именно Наполеон III, который лично начал спонсировать исследование направленные на получение необычного металла в больших объемах. Так в 1855 году изделия из него были главной достопримечательностью на Универсальной выставке в Париже, а Наполеон III называл его "своим личным металлом".
Следующие десятилетия по всей Европе появляется настоящая мода на него; изготавливаются ювелирные украшения, зачастую одновременно с золотом, шкатулки, элементы одежды и ценные предметы интерьера. Блеск металла напоминает серебро, но стоит он гораздо дороже.
Однако Наполеона III изначально интересовали его уникальные физические свойства, применение которым нашлось бы в военном деле.
Концом моды на этот ювелирный металл и началу его промышленного применения послужило открытие в 1886 году нового способа его получения: электролиз глинозёма в расплавленном криолите, где он содержался в больших количествах. Если до этого за последние 45 лет в мире было получено 200 тонн металла, то с открытием нового способа счет стал идти на десятки тысяч тонн в год, в 1940 году было получено 1 млн. тонн, а сейчас ежегодно получают свыше 50 млн тонн.
Этим металлом является алюминий.
P.S. поздравляю сообщество с одним годом на пикабу и с 3k подписчиками
Орихалк - таинственный металл
В стародавние времена еще древнейшими греческими авторами, вроде Гомера и Гесиода упоминается неизвестный металл "сияющий, как локоны Афродиты" и "настолько прочный, что из него был изготовлен щит Геракла". Название этому металлу орихалк, и до сих пор не установлено существовал ли он на самом деле. Другое его известное упоминание появилось более чем 200 лет спустя вышеприведенных эпитетов:
"Большую часть потребного для жизни давал сам остров, прежде всего любые виды ископаемых твердых и плавких металлов, и в их числе то, что ныне известно лишь по названию, а тогда существовало на деле: самородный орихалк, извлекавшийся из недр земли в различных местах острова и по ценности своей уступавший тогда только золоту..."
"Отношения атлантидцев друг к другу в деле правления устроялись сообразно с Посейдоновыми предписаниями, как велел закон, записанный первыми царями на орихалковой стеле, которая стояла в средоточии острова — внутри храма Посейдона». Кроме того, «стены вокруг наружного земляного кольца цитадели они по всей окружности обделали в медь, нанося металл в расплавленном виде, стену внутреннего вала покрыли литьем из олова, а стену самого акрополя — орихалком, испускавшим огнистое блистание..."
Данное описание 2400 лет назад представил Платон в своем диалоге "Критий", содержащий рассказ со слов последнего о могущественном островном государстве Атлантида. Таким образом, орихалк уже во времена Древней Греции считался полумифическим материалом, известным лишь по названию, поскольку события связанные с Атлантидой описываются Платоном, как произошедшие 9000 лет назад (чего на самом деле не может быть, поскольку 11 400 лет назад, считая от нашего времени, еще не закончился Ледниковый период).
Тем не менее, упоминания орихалка случалось и в более поздние времена... Иудейский историк I века Иосиф Флавий сообщал, что из него были изготовлены священные сосуды в храме Соломона, а Плиний Старший полагал, что металл вышел из употребления по причине истощения всех месторождений, которыми когда-то были богаты берега Черного моря.
Чем же мог быть легендарный орихалк? Само название ὀρείχαλκος дословно переводится, как "горная медь", логично предположить, что это какой-то сплав или материал на основе меди. Рассмотрим возможные варианты:
1. Латунь.
Сплав меди с цинком, он имеет описываемый золотой цвет, давно известен цивилизации, а некоторые разновидности по прочности не уступают бронзе. В современном греческом ορείχαλκος как раз и означает "латунь". Но проблема в том, что во-первых, это хорошо знакомый древним грекам материал, а не "известный ныне только по названию", как писал Платон. А во-вторых, латунь не встречается в самородном виде; греки получали его сплавлением меди с цинковой рудой (цинкит, сфалерит), а самородная медь с природной примесью цинка все же маловероятна. Однако подтверждением этой версии может служить один факт: в 2014 году к югу от Сицилии бы обнаружен греческий корабль начала VI века до н.э. со слитками, как многие считают именно орихалка. Но анализ выявил содержание 75% меди, 15% цинка и 5% никеля, железа, свинца, что в целом соответствует составу латуни.
2. Сплав меди и золота
Это бы объясняло высокую ценность орихалка, однако добавка золота ухудшило бы свойство меди, и едва ли Гераклу пригодился бы щит из такого мягкого и тяжелого сплава. Считается, что гипотеза орихалка, как сплава Au-Cu, появилась из-за неправильной транслитерации греческого на латынь: orichalcum (горная медь) превратилась в aurichalcum (золотая медь), и из-за этой ошибки смысл значения полностью изменился, хоть и медьсодержащие золотые самородки иногда встречаются в природе.
3. Халькопирит
Медный колчедан, двойной сульфид меди и железа (CuFeS2) - минерал с характерным золотым металлическим блеском. Является распространенной медной рудой, но как облицовочный материал ввиду своей невысокой прочности навряд ли мог служить. Однако не исключено, что у греков существовал особый способ извлечения металла из халькопирита.
Но и есть так сказать "обобщающая теория", что греки и римляне могли применять это название ко всем медьсодержащим материалам золотистого цвета (и халькопирит, и латунь и др. сплавы). Так традиционно в нумизматике орихалком называют сплав, используемый для чеканки сестерций (римская монета I века), состоящий из бронзы с добавкой серебра.
В настоящее время орихалк по большей части стал известен благодаря разнообразным фэнтези-вселенным, как вымышленный прочный металл золотистого или зеленого оттенка.
Гетерополисоединения
Пока выдалось время, решил сделать пост о теме своей научной статьи и бакалаврской работы.
(Описывал наиболее понятным языком, но те, кто о химии вообще не имеет представления, хотя бы посмотрят фотки и картинки)
Итак, что же такое гетерополисоединения? В химии существует такой тип веществ, под названием полиоксометаллаты. Известным еще со школы веществом данного типа является дихромат, который получают подкислением хроматов:
(Или получение конкретно дихромата калия из хромата калия)
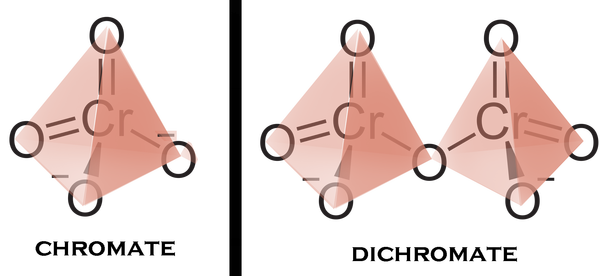
Это хорошорастворимые соли хромовой и дихромовой кислоты соответственно, и имеют следующий внешний вид:
Но больше интересна их структура. Хромат-анион представляет из себя своего рода тетраэдр, с хромом в центре и кислородами на вершинах. Структура дихромат-аниона отличается тем, что представляет из себя два тетраэдра, при том что один из кислородов является общей вершиной для двух тетраэдров, иначе говоря образуется "мостиковая связь" металл-кислород-металл. Это вещество можно отнести к самому простому примеру полиоксометаллата.
Однако анионы кислот других переходных металлов образуют более сложные по структуре полиоксометаллаты (например при подкислении молибдата получается структура, состоящая из семи октаэдров, содержащих в центре молибден и кислород на вершинах)
Вышеописанные разновидности полиоксометаллатов называются изополиоксометаллаты.
Но существует еще второй вид, с более сложной структурой и называется он гетерополиоксометаллаты или гетерополисоединения (ГПС).
Гетерополисоединения образуются, когда процесс подкисления происходит в присутствии постороннего кислородосодержащего аниона, от которого в последствии отщепляется и попадает в структуру гетероатом (например фосфор, при подкислении вольфрамата в присутствии фосфата)
Структура ГПС, изображенного в примере выглядит следующим образом: Фиолетовый шарик в центре - это фосфор (гетероатом). В центре каждого из 12 синих октаэдров находится вольфрам (полиатом) , а на вершинах - кислород, который может являться одновременно вершиной двух октаэдров. Такая структура носит название Структура Кеггина
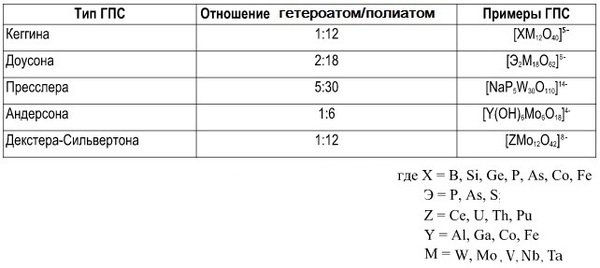
Всего есть 6 основных структур (не считая множество их изомеров), которые синтезируются исходя из начальных пропорций веществ, содержащих гетероатом и полиатом.
Все это говорит о том, что существует огромное количество различных ГПС с различными свойствами и областями применения, так например кремниево-ванадиевые соединения используются при получении антибиотиков, а фосфорно-молибденовые, как оранжевый пигмент.
Однако моя работа посвящена конкретному фосфорно-молибдо/вольфрамовуму гетерополисоединения со структурой Доусона (аналогично, предыдущей модели, два фосфора внутри структуры, в общей сложности 18 молибдена/вольфрама внутри каждого октаэдра и 62 кислорода на вершинах октаэдров)
Соединения структуры Доусона обладают очень большой растворимостью (ок 200г/л), что облегчает работу с ними. Получается такое ГПС подкислением солей вольфрамовой и молибденовой кислоты в присутствии фосфатов (но в других пропорциях, нежели для структуры Кеггина)
Одновременно вольфраматы и молибдаты берут не случайно; соли вольфрама устойчивы, но являются плохими окислителями, молибден же наоборот - соли не такие устойчивые, но зато обладают окислительными способностями. В связи с этим, целесообразно рассматривать два соединение с отношением W:Mo=12:6 и W:Mo=6:12.
При выделении гетерополисоединений из раствора они образуют монокристаллы, к сожалению очень маленького размера, так что для их наблюдения используется оптический микроскоп. Так же следует заметить, что ГПС очень гигроскопичные вещества, даже в сухом виде на одну их молекулу приходится 11 молекул воды. Ниже приведены фотографии кристаллов ГПС с соотношением W:Mo=12:6 и 6:12 соответственно
(100 µm = 0,1 мм; примерно ширина человеческого волоса)
Как видно, образуются ромбоэдрические кристаллы. Наблюдать их можно только в маточном растворе, поскольку при полном осушении они срастаются и разделить их уже становится невозможно. Благодаря образованию монокристаллов возможно определить атомную структуру конкретного образца, проводя рентгеноструктурный анализ. Молекулярные массы вышеизображенных веществ чрезвычайно велики: 4144 г/моль для (NH4)6(P2W12Mo6O62)*11H2O и 3616 г/моль для (NH4)6(P2W6Mo12O62)*11H2O.
Интересная особенность ГПС, требующая и сейчас дополнительных исследований, это реакция р-ра с металлами. В результате последние могут вставать на место полиатома (замещать вольфрам/молибден) и образовывать насыщенные синие и зеленые р-ры. Ниже приведены сильноразведенные растворы продукта реакции ГПС с металлическим серебром и железом (конц. 0.05% по массе)
Эти вещества также могут образовывать монокристаллы, правда еще меньшего размера, вплоть до диаметра лейкоцитов. Ниже приведены кристаллы, образовавшиеся в ходе реакции ГПС с металлическим цинком, железом и никелем соответственно:
Но все же, поиск практического применения этой способности ГПС реагировать с металлами, является сейчас объектом исследований.
Гетерополисоединения обладают еще одной интересной особенностью, которую как раз я и описываю в своей дипломной работе и год назад получил патент: вещество может взаимодействовать с солями переходных элементов в низшей степени окисления (например сульфат кобальта (II) или хлорид марганца (II) ) и образовывать так называемые гетерополикомплексы, где ион переходного металла (катион) будет связан с гетерополианионом.
Интересная особенность в том, что этот комплекс очень "чувствителен" к аммиаку и органическим азотистым производным: ГП-анион понижает электродный потенциал катиона, иначе говоря позволяет катиону переходного металла образовывать комплекс с азотистым производным и легко переходить в окисленную форму (в Co(III) или Mn(III)), образуя комплекс насыщенного синего цвета, соответственно концентрации присутствующего азотистого соединения. А поскольку большинство органических соединений-примесей не поглощают синий цвет и оптически не мешают определению искомого вещества, то образование определенного синего оттенка легко улавливается спектрофотометром, показания которого и говорят о той или иной концентрации.
Проще говоря, это новый спектрофотометрический метод определения концентрации азотистых соединений в атмосфере (вплоть до 0,001%), имеющий ряд преимуществ перед существующими методами, в которых порой используется токсичные реактивы или сложное оборудование, которое требует определенной квалификации от рабочего.
На данный момент синтез гетерополикомплекса находится еще в процессе и занимает 7-10 дней (проходит реакция между перетёртыми в ступке семиводным сульфатом кобальта(II) и ГПС с отношением W:Mo=12:6, 9:9 и 6:12, представленные соответственно на фото)
В дальнейшем, образцы будут протестированы на этилендиаминтетрауксусной кислоте, проведен ряд анализов, в частности ИК-спектроскопия, которая даст точные данные о составе и строении вещества.
Тем не менее, всё, что здесь описано - лишь крупица в изучении ГПС. Вещества, образованные различными элементами, имеющие ту или иную структуру и её изомер, обладают различными свойствами и находят себе применение в качестве аналитических реагентов, в нефтяной и газовой промышленности, в медицине и технике, а также в других отраслях науки, развитие которых является основной задачей на данный момент.
P.S. если вы поняли всё, что здесь описано, то ваше понимание химии как минимум на уровне четвертого курса)
Франций
Публикуя гифки с различными реакциями щелочных металлов, в комментах достаточное количество людей интересовалось францием в этом плане.
Теперь же, дабы расставить все точки над i... С францием, увы, гифок нет. Так что вместо этого я рассажу непосредственно про него, а заодно почему нет гифок.
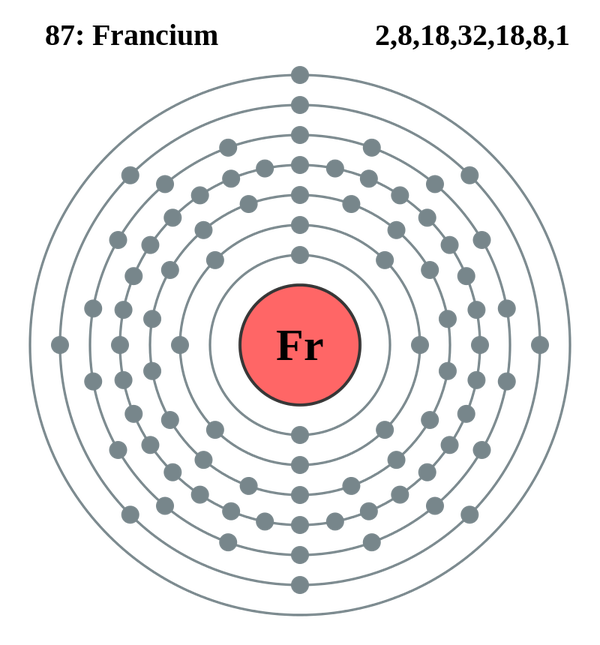
Франций - последний из открытых элементов группы щелочных металлов (хотя гипотетически, следующий щелочной металл (элемент № 119) это унуненний, но его еще даже не открыли).
Франций также был предсказан задолго до своего открытия, еще 1870-х годах. Тогда же и вплоть до его открытия, франций именовали "эка-цезием". В начале XX века было множество неудачных попыток его открытия, так как за него принимали радиоактивные изотопы уже известных щелочных металлов. Но все же, в 1939 году, неизвестный на тот момент элемент, был замечен Маргаритой Перей, сотрудницой Института Кюри в Париже, как продукт альфа-распада актиния-227, содержащийся в минерале Настуран.
Позже, 1946 году элементу дали название "франций", в честь родины первооткрывательницы.
Интересный факт, что изначально сама Перей, предлагала назвать его котий (catium), поскольку элемент имеет самый электроположительный катион, но из-за большей ассоциацией с котами, а не с катионами предложение отклонили и остановились на варианте с францием
На данный момент известно 34 изотопа франция. Самые стабильные из них франций-223 и франций-221. Франций-223, тот самый, что был найден в настуране, представляет из себя продукт серии актиниевого распада. В то же время его продуктом после бета-распада является радий-223. Франций-221 - продукт серии нептуниевого распада, образующийся из актиния 225, и сам распадающийся на астат-217. Период их полураспада 22 минуты (у франция-223) и 5 минут (у франция-221), таким образом найденный Перей изотоп - самый стабильный.
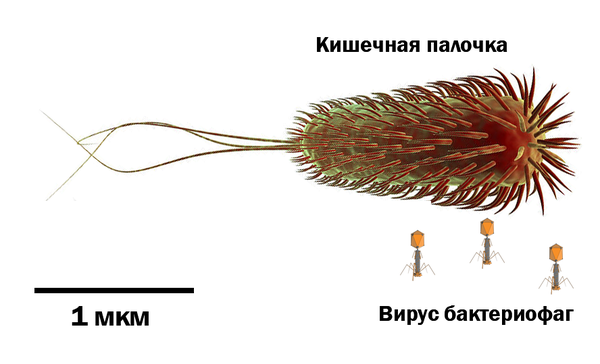
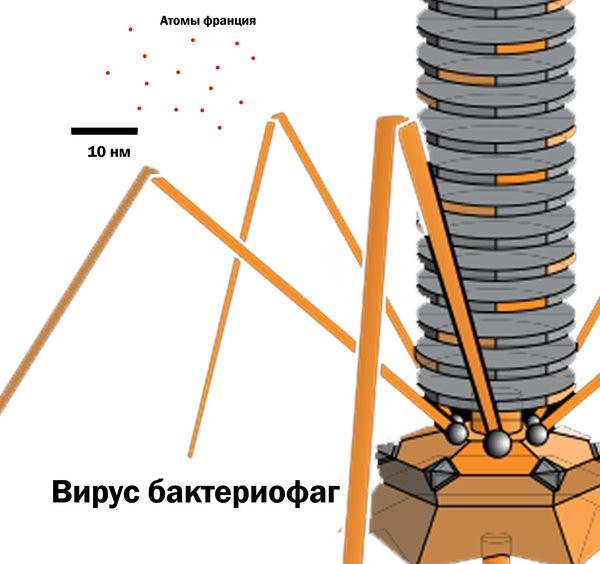
(ниже представлено изображение искусственно-полученного франция-223 в магнитно-оптической ловушке количеством в 300k атомов)
"Но как же он существует в природе, если период жизни самого стабильного изотопа 22 минуты?" - спросите вы. Все дело в непрерывном распаде в радиоактивных минералах. В нижеизображенном образце настурана, франция всегда, в любой момент времени, 3,3 × 10^-20 грамм, ибо "тот франций, что был 22 минуты назад" превратился в радий, а некоторое количество актиния, существовавшее 22 минуты назад превратилось во франций, таким образом его всегда одно и то же количество.
Зная концентрацию урановых минералов в земле и концентрацию в них франция, можно также посчитать количество всего франция в земной коре в любой момент времени - это примерно 30 грамм. Собственно, это и ответ на вопрос, почему нет гифок с ним.
Несмотря на чрезвычайную редкость, некоторые свойства этого металла, как усредненные свойства его изотопов, все же известны...
В целом химические свойства франция были бы похожи на свойства цезия, только протекали бы еще более бурно. Как и все щелочные металлы, франций реагировал бы с кислородом воздуха, образуя оксиды и пероксиды, а также с водой, образуя щелочь.
Плотность франция 1,87 г/см³ (в 3,5 раза больше, чем у лития, но в 1,4 меньше, чем у алюминия).
Температура плавления 20С, что делало бы его третьим жидким при н.у. элементом, кроме ртути и брома (у галлия и цезия Тпл 28 градусов, так что они считаются твердыми при стандартных 298К (25С))
Франций обладает самыми низкими показателями электроотрицательности, и если бы его использовали в химии, то он был бы сильнейшим существующим восстановителем.
Неподтвержденное, но все же имеющее место предположение последних лет гласит, что в теории металлический франций может иметь цвет от золотистого (подобно цезию) до вовсе красного.
Франций имеет самый большой размер атомов - 0,54 нм. Это в 2 раза больше атома урана, в 4,5 раза больше, чем атом кислорода и в 8,5 раз больше атома водорода.
Увы, по понятным причинам, франций не нашел практического применения, однако был проект его использования в лечении раковых заболеваний, но опять же из-за его редкости проект признали нецелесообразным.
Предыдущие посты с гифками:
Литий ( http://pikabu.ru/story/litiy_v_gifkakh_4799967 )
Калий ( http://pikabu.ru/story/natriy_v_gifkakh_4794517 )
Натрий ( http://pikabu.ru/story/kaliy_v_gifkakh_4789949 )
Рубидий ( http://pikabu.ru/story/rubidiy_v_gifkakh_4787060 )
Цезий ( http://pikabu.ru/story/tseziy_v_gifkakh_chast_ii_4785195 )
А также ждите гифки с реакциями других элементов ;)