Рябина в химии
Сентябрь приходит незаметно, а вместе с ним наступают осенние холода, опадают листья и конечно же краснеет рябина. Для многих она не является чем-то особо примечательным, однако именно благодаря плодам рябины в своё время были открыты совершенно новые и перспективные вещества, и сегодня лучший день чтобы поговорить об этом.
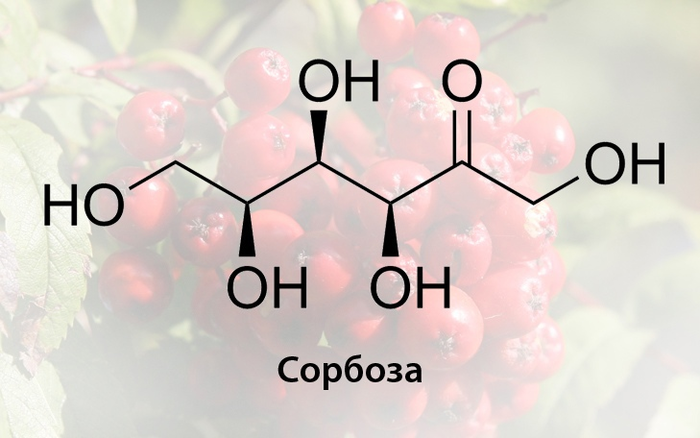
Первым таким соединением была сорбоза — моносахарид, который в 1852 году обнаружил французский химик Теофиль-Жюль Пелуз в сброженном бактериями рябиновом соке. В чистом виде это кристаллическое вещество сладковатое на вкус, образующее два стереоизомера (D- и L-формы) с температурой плавления 159 — 161 °C. Из неё оказалось возможным синтезировать аскорбиновую кислоту, таким образом сорбоза и сейчас является важным промежуточным продуктом в синтезе Рейхштейна (микробиологический процесс производства витамина С из D-глюкозы) и, кроме того, выделить другие новые соединения, наибольшую востребованность из которых получил шестиатомный спирт сорбит.
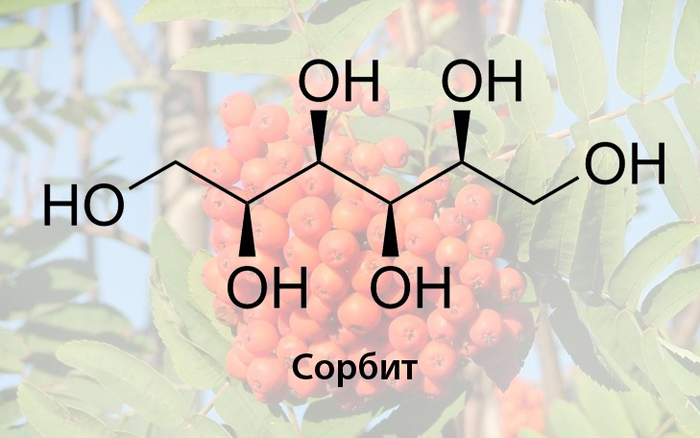
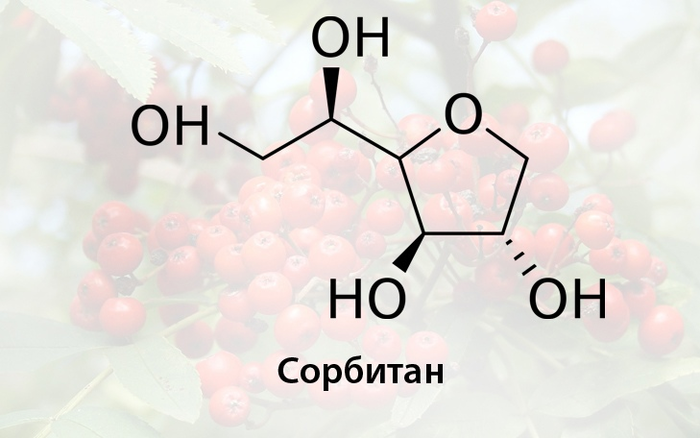
Сорбит содержится непосредственно в рябиновом соке (ок 7%), в чистом виде образует бесцветные кристаллы, которые плавятся при 112°C. Это достаточно распространенный заменитель сахара в диетических продуктах, являющийся низкокалорийным подсластителем, который медленно метаболизируется человеком, но в то же время обладает желчегонным эффектом и при избыточном потреблении способен вызвать нарушение всасывания фруктозы и другие проблемы с кишечником. В то же время, сорбит это достаточно распространенный загуститель и весьма гигроскопичное вещество, которое идёт на производство гелей. При восстановлении сорбита может быть получен гексан, а при дегидратации — сорбитан
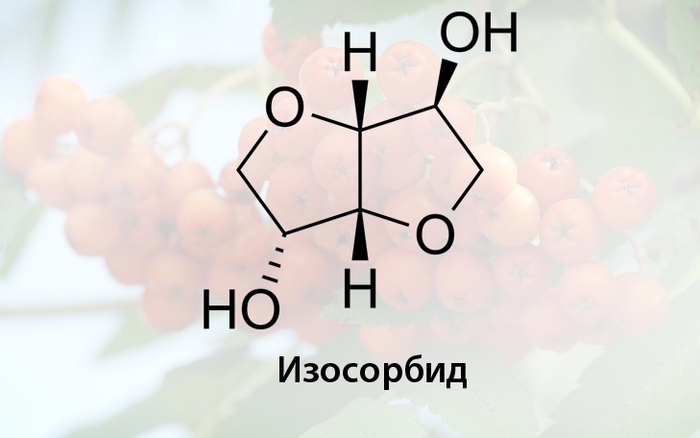
Сорбитан по физическим свойствам сходен с сорбитом и используется в производстве ПАВ, в частности его этоксилированные эфиры (полисорбаты) являются важными биоразлагаемыми эмульгаторами, которые находят применение в фармацевтике и пищевой промышленности. При дальнейшей дегидратации из сорбитана можно синтезировать изосорбид
Изосорбид является бициклическим соединением (состоит из двух фурановых колец), имеет вид сильно гигроскопичных белых хлопьев, которые плавятся при 63 °C, в связи с этим используется как увлажнитель и находит применение в медицине в качестве осмотического мочегонного средства. Продукт нитрования изосорбида обладает сосудорасширяющим действием и применяется в лечении стенокардии, а простые изосорбидные эфиры всё чаще используются в качестве возобновляемого растворителя для косметических и фармацевтических препаратов. В целом, изосорбид — это универсальный продукт, получаемый из возобновляемых ресурсов в промышленных количествах, который также представляет большой научный и технический интерес как мономерный строительный блок для биополимеров.
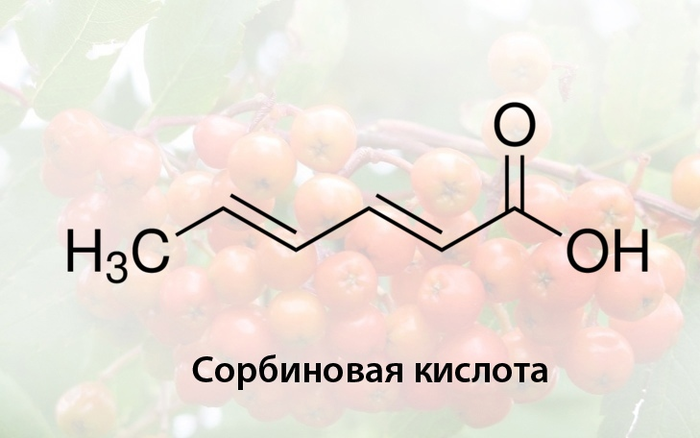
Ещё одним веществом, которое впервые обнаружили в соке незрелой рябины (концентрация ок. 0.14%) является сорбиновая кислота. Позже её смогли синтезировать искусственно путем конденсации малоновой кислоты и кротонового альдегида в пиридине. Сорбиновая кислота, в отличие от производных сорбита, слабо растворяется в воде и легко сублимируется. Сейчас это зарегистрированный консервант, который добавляется в безалкогольные напитки, кондитерские изделия и сгущенное молоко для предотвращения плесневения. Аналогичными свойствами обладают и некоторые соли (сорбаты калия, натрия и кальция). Ежегодно в ходе реакции конденсации производится около 30000 тонн консерванта. В этом процессе важным условием является не допустить образование парасорбиновой кислоты.
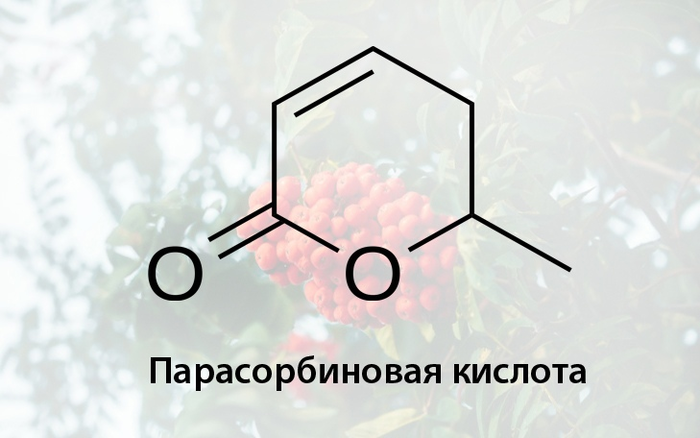
Парасорбиновая кислота представляет из себя летучую жидкость, которая также может присутствовать в соке ягод, но уже является токсичным соединением, вызывающим тошноту и расстройство желудка, однако в результате термической обработки превращается в сорбиновую кислоту.
И это лишь малая часть от всех веществ, присутствующих в рябине. Плоды содержат также аскорбиновую кислоту, большое количество полифенольных соединений (в частности производные кемпферола, кверцитина и изорамтенина), а характерную красную окраску придают антоцианы и каротиноиды (главным образом α-каротин). Для многих животных в зимнее время года, рябина служит единственными источником вышеперечисленных веществ, так что на деле эти неприглядные ягодки являются неотъемлемым звеном экосистемы и играют важную роль в развитии науки.
Подобные и прочие посты также на странице ВК: vk.com/mircenall