Материал взят https://stanmolod.ru/omolozhenie-organizma/lechenie/telomeraza-eliksir-bessmertiya.html и с Википеди
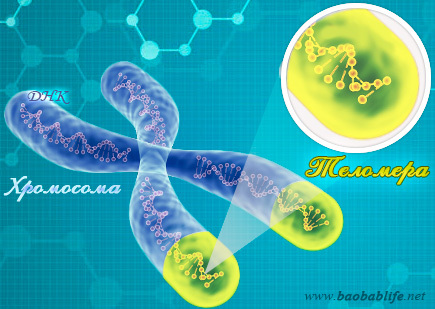
Теломераза — фермент, добавляющий особые повторяющиеся последовательности ДНК (TTAGGG у позвоночных) к 3'-концу цепи ДНК на участках теломер, которые располагаются на концах хромосом в эукариотических клетках. Теломеры содержат уплотнённую ДНК и стабилизируют хромосомы. При каждом делении клетки теломерные участки укорачиваются. Существование механизма, компенсирующего укорочение теломер (теломеразы), было предсказано в 1973 году А. М. Оловниковым[1].
Теломераза является обратной транскриптазой, причём с ней связана особая молекула РНК, которая используется в качестве матрицы для обратной транскрипции во время удлинения теломер.
Теломераза была обнаружена Кэрол Грейдер в 1984 году[2]. https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BB%D0%BE%D0%BC%D0%B5%D1%80%D0%B0%D0%B7%D0%B0
Теломераза – эликсир бессмертия?
Победить старение организма и приобрести бессмертие мечтает человечество на протяжении всего своего существования. Над достижением этой цели сейчас работают лучшие биологи мира. Возможно, мы подошли к ней уже совсем близко. Теломераза – недавно открытый фермент, отвечающий за бессмертие организма. Но чем будет это открытие? Спасением, сбывшейся мечтой или новым бичом человечества?
Почему мы стареемПочему мы стареем
Совсем недавно было открыто, что за старение или бессмертие клеток отвечают окончания хромосом, названные теломерами. Апоптоз – биологически запрограммированный процесс старения клетки. Его задача в том, чтобы не дать размножаться клеткам с поврежденными ДНК. У многоклеточных организмов апоптоз отвечает за морфогенез – правильное образование и развитие тканей и органов. Делается это при помощи контроля скорости деления клеток. Одни клетки размножаются быстрее и давят на соседние ткани, в результате орган занимает нужное положение в организме.
Находящиеся на концах хромосом теломеры отвечают не только за бессмертие или старение организма. Они также предохраняют соединение хромосомы с участками ДНК других хромосом, таким образом, препятствуя мутации клетки. Старение основано на неспособности ДНК-полимеразы (фермента отвечающего за копирование ДНК при размножении клетки) копировать ДНК с самого её конца. Таким образом, при каждом делении теломеры на концах хромосом становятся всё короче. Этот процесс длительный, но со временем теломеры исчезают, ДНК хромосом начинает набирать ошибки и возникает мутация клетки. Со временем мутации достигают такого количества, что клетка становится неспособной обеспечивать саму себя питательными веществами и поддерживать постоянство внутренней среды. Клетка погибает.
Однако некоторые клетки имеют кардинальное отличие. Клетки внутренней стенки кишечника, клетки, отвечающие за образование сперматозоидов, а также бактерии и раковые клетки могут делиться бесконечно долго и никогда не стареют. Эта способность обеспечивается особым ферментом, способствующим копированию цепочки ДНК с самого её конца. Таким образом, ответственные за сохранение целостности хромосомы теломеры никогда не исчезают, и клетка становится бессмертной. Этот фермент называется теломераза.
Почему возникает ракПочему возникает рак
В норме при исчезновении теломер, ДНК клетки с каждым делением накапливает ошибки. В результате ДНК приходит в негодность и клетка гибнет. Но бывает так, что очередная мутация затрагивает участок, кодирующий фермент теломеразу. Из-за этого уже накопившая ошибки ДНК прекращает свое дальнейшее разрушение, давая клетке бессмертие. Но из-за накопленных ошибок клетка не может выполнять свои функции, с этого момента все ресурсы клетки тратятся исключительно на её размножение. Ткань становится злокачественным новообразованием.
Нужно понимать, что активация теломеразы не является причиной появления рака. Например, клетки эндотелия кишечника благодаря теломеразе бессмертны, но при этом не являются злокачественными и успешно выполняют свои функции. Злокачественное образование имеет два кардинальных отличия:
— бессмертие клеток ткани в результате активации теломеразы;
— ошибки в ДНК клетки, из-за чего она не выполняет свои функции.
Именно оба этих фактора, а не только первый, отличают злокачественные клетки.
Теломераза и медицинаТеломераза и медицина
Способность влиять на теломеразу – ключ к бессмертию и избавлению человечества от онкологических заболеваний. Для избавления от рака необходимо научится отключать теломеразу у отдельных клеток, не затрагивая её функции в остальных тканях и органах. Добиться этого можно путем введения необходимых ферментов местно, в злокачественные ткани.
Добиться бессмертия – задача более сложная. При этом активирующий теломеразу препарат ТА-65 уже получен и поступил в продажу. Но изучение теломеразы не доведено до конца, некоторые её функции в различных тканях ещё не изучены. Несмотря на позитивные результаты от применения препарата, многие врачи рекомендуют использовать его только с разрешения специалиста и при его контроле. Другие врачи рекомендуют отказаться от препарата вовсе.
Препарат ТА-65Препарат ТА-65
Главным компонентом препарата является циклоастрогенол – вещество природного происхождения, содержащееся в корне перепончатого астрагала. Его способность активировать теламеразу была доказана ещё в 2009 году. Вещество было опробовано на мышах. В ходе экспериментов обнаружилось, что препарат возвращает молодость особям, избавляет от многих хронических заболеваний. Негативных побочных эффектов не было обнаружено.
Несмотря на это некоторые врачи рекомендуют воздержаться от покупки препарата, обосновывая это отсутствием длительных клинических испытаний на людях. Тем не менее, препарат поступил в продажу и уже имеет множество постоянных покупателей. Курс приема ТА-65 рассчитан на три месяца, после чего необходимо делать перерыв на несколько недель. В день принимают от 1 до 4 таблеток. Их назначение возможно лишь в специализированных клиниках, после выяснения биологического возраста. Стоимость колеблется в зависимости от страны и способа приобретения. Упаковка в 30 таблеток оценивается в 15-25 тысяч рублей, упаковка в 90 таблеток оценивается в 40-55 тысяч рублей.
Теломеры – индикатор биологического возраста. Учёные приблизились к разгадке тайны вечной молодости3 июля 2018
В 30–40-е годы XX века отечественные учёные ввели понятие, отражающее уровень сохранности организма – биологический возраст. Скорость старения у каждого человека индивидуальна. Определить степень износа его органов и систем помогут теломеры, а точнее – их длина. Что это такое? Можно ли остановить биологические часы? Читайте о последних научных изысканиях, связанных с омоложением организма.Когда размер имеет значение. Короче теломеры – короче жизнь
Теломеры (от др.-греч. τέλος – конец и μέρος — часть) представляют собой некие наконечники на концах хромосом, состоящие из строго определённой последовательности сложных органических соединений – нуклеотидов. При рождении длина таких наконечников составляет 15 тысяч пар нуклеотидов, к пятилетнему возрасту она сокращается до 12 тысяч, а хронические заболевания могут уменьшить размеры концевых участков хромосом до 5–2 тысяч пар нуклеотидов.
Учёные обнаружили теломеры в середине прошлого столетия в клетках ядерных живых организмов (то есть организмов, клетки которых содержат ядро). Поначалу их роль не была понятна. Наконечники не содержат генов, несут довольно-таки мало информации, которая ничего не кодирует и не считывается на информационные рибонуклеиновые кислоты.
Позже стало ясно: их функция – в обеспечении защиты хромосом от разрушения и слипания, а также сохранности наследственного материала (генома) в процессе деления клетки и удвоения ДНК (дезоксирибонуклеиновой кислоты).
Последняя представляет собой своеобразный биологический жёсткий диск с записанной на нём генетической программой развития и функционирования живого организма. ДНК позволяет хранить, передавать следующему поколению и реализовывать названную программу.
Объёмы памяти созданного природой «диска» поражают: вместимость грамма одной нити ДНК сопоставима с аналогичным показателем 100 миллиардов DVD – 455 экзабайт. А информацию, записанную на нём, можно прочитать даже по прошествии нескольких тысячелетий.
Механизм удвоения ДНК не позволяет копировать теломеры, а потому при каждом делении клетки – а большинство человеческих клеток способно делиться лишь 52 раза (предел Хейфлика) – наконечники хромосом укорачиваются на 50–200 нуклеотидов (согласно Harley C. B., Futcher A. B., Greider C. W.).Почему клетки стареют
Почему клетки стареют? Рано или поздно наступает момент, когда размер теломер становится настолько мал (3000–5000 пар нуклеотидов или 2 kb), что клетка не может больше удваиваться, наступает её генетически запрограммированная смерть – апоптоз.
Если же клетка категорически не желает гибнуть, её уничтожают клетки иммунной системы. В тех случаях, когда последние по тем или иным причинам не выполняют должным образом свои функции, в организме накапливается большое количество старых клеток.
Об их влиянии на состояние окружающих молодых «коллег» и в целом на организм, осуществляемом, по-видимому, при помощи неких сигнальных молекул, пока можно лишь догадываться. Предполагается, что присутствие нефункционирующих долгожителей может стать причиной воспаления, перерождения молодых клеток в злокачественные. Клеточное старение (сенессенс) и старение организма – два звена одной цепи.
Ещё одно негативное последствие того, что хромосомы утрачивают свои защитные колпачки, состоит в опасности склеивания «оголённых» концов молекул ДНК. Дело в том, что клетка воспринимает сверхкороткие теломеры как разрывы хромосом и стремится их починить путём их соединения. Подобное чревато появлением мутаций, приводящих к развитию онкологических заболеваний.
На сегодняшний день известны результаты более 8 тысяч исследований, доказывающих, что длина концевых участков хромосом тесным образом взаимосвязана с биологическим возрастом человека. Чем короче хромосомные наконечники, тем больше изношен организм и тем скорее наступит смерть.Теломеры помогают предсказать развитие рака
Специалисты Медицинского университета г. Инсбрук (Австрия) с 1995 по 2005 год наблюдали за 787 добровольцами 40–79 лет, не страдавших раком. В начале исследования у каждого из них была определена длина теломер в лейкоцитах капиллярной крови. За 10 лет у 11,7 % испытуемых развилось какое-либо онкологическое заболевание. Средняя длина концевых участков хромосом у заболевших была значительно меньше, чем у здоровых участников. Причём самые короткие теломеры наблюдались у пациентов с наиболее тяжёлыми формами рака – желудка, яичников и лёгких. Учёные сделали выводы: у людей с критически короткими хромосомными наконечниками риск возникновения злокачественного новообразования в 3 раза выше, чем у тех, кто может похвастать максимальной длиной теломер, а риск умереть от рака в десятилетний период – в 11 раз выше.Теломеры: какие факторы определяют их длину
https://yandex.ru/turbo?text=https%3A%2F%2Fosteomed.su%2Ftelomery%2F&d=1
Теломеры могут укорачиваться быстрее или медленнее.
Исследования показали, какие факторы влияют на длину хромосомных наконечников.
1. Стресс уменьшает размеры теломер (Элисса С. Эпель, Jue Lin, Frank H. Wilhelm и другие, 2006 г.). 2. Различные недуги: ожирение (сокращает длину теломер на 240 пар нуклеотидов), резкие скачки веса из-за увлечения диетами (S. Kim, C. G. Parks, L. A. DeRoo и другие, 2009 г.), сахарный диабет, разрушение хрящевой ткани, гипертензия, ишемическая болезнь, инфекционные заболевания (в частности, заражение инфекцией Salmonella enteric), воспалительные процессы (например, язвенный колит). 3. Некоторые модели мышления, отличающиеся повышенной озлобленностью, назойливыми мыслями о том, что людям нельзя доверять (L. Brydon, J. Lin, L. Butcher, M. Hamer и другие, 2012 г.), пессимизмом (A. O´Donovan, J. Lin, F. S. Dhabhar и другие), постоянным мысленным проговариванием своих проблем и подавлением нежелательных мыслей и эмоций (M. Alda, M. Puebla-Guedea, B. Rodero и другие, 2009 г.) ускоряют старение. У жизнерадостных людей теломеры длиннее. Причём, согласно исследованиям, эта разница может достигать 30 %. 4. Социальный статус. Чем он ниже, тем концевые участки хромосом короче (исследователи под руководством профессора T. D. Spector из Отделения исследований близнецов и генетической эпидемиологии Больницы Святого Фомы, г. Лондон). 5. Брак. Люди, не состоящие в браке и не имеющие постоянного партнёра, имеют теломеры меньших размеров. Правда, если брак сопряжён с регулярным семейным насилием, наконечники также будут короткими из-за влияния стресса (Элизабет Блэкберн). 6. Физическая активность (специалисты Колорадского университета, 2010 г.). Теломеры у активных людей на 200 пар нуклеотидов длиннее, чем у тех, кто ведёт сидячий образ жизни. 7. Курение. Одна пачка сигарет, выкуриваемая изо дня в день в течение года, укорачивает хромосомные наконечники на 5 пар нуклеотидов. Степень их повреждения соответствует 11 годам клеточного старения (A. R. Zota, B. L. Needham, E. H. Blackburn и другие, 1999–2002 гг.). 8. Сладкая газированная вода. Ежедневное употребление 2 банок напитка ускоряет старение на 4,6 лет (C. W. Leung, B. A. Laraia, B. L. Needham, 2014 г.). Уровень липидов в крови. Чем их меньше, тем теломеры длиннее. Присутствие в организме большого количества свободных радикалов (Packer, Fuehr, 1977 г., Zglinicki и другие, 1995 г., Chen, Ames, 1994 г.). 9. Скудный рацион питания. Дефицит омега-3 жирных кислот (R. Farzaneh-Far, J. Lin, E. S. Epel и другие, 2010 г.), минералов и витаминов в организме, особенно фолиевой кислоты, магния, цинка, витаминов С, Е, К, В6, В12, D укорачивает длину концевых участков хромосом на 5 % (это составляет 350 пар нуклеотидов). Аналогичным действием обладает употребление технологически переработанного мяса – копчёного, вяленого, солёного, а также колбас, сосисок, ветчины, солонины (J. A. Nettleton, A. Diez-Roux, N. S. Jenny и другие, 2008 г.). 10. Грудное вскармливание. Дети, которые в первые 4-6 недель своей жизни питаются исключительно молоком матери, имеют теломеры на 5 % длиннее, чем у сверстников-искусственников (Wojcicki и другие, 2016 г.). 11. Роды. Исследователи из Университета Джоржа Мэйсона (США) под руководством Анны Поллак установили: чем большее количество раз женщина рожала, тем короче защитные колпачки на её хромосомах. Рождение одного ребёнка сокращает длину теломер на 4,2 % (это равноценно 11 годам клеточного старения), пятерых – на 12,7 %.Еще один повод не рожать
12. Солнечные лучи. Теломеры открытых участков кожи значительно короче своих «коллег» с защищённых от ультрафиолета мест (Петра Букамп из Гейдельбергского центра исследования рака). 13. Продолжительность сна. Чем дольше человек спит, тем длиннее защитные колпачки на его хромосомах. Минимальное время сна, согласно исследованиям, должно быть 7 часов (K. A. Lee, C. Gay, J. Humphreys и другие, 2014 г.). 14. Некоторые компоненты краски и бытовой химии (S. Pavanello, A. C. Pesatori, L. Dioni и другие, 2010 г.).
В общем все исследования последних лет лишь объяснили с точки зрения физиологии человеческого организма то, что и так было давно известно из практики и наблюдений: правильное питание, здоровый сон, физическая активность, оптимизм продлевают жизнь, а вредные привычки, стрессы и болезни, напротив, укорачивают её.Теломеры: можно ли сделать их бессмертными и остановить клеточное старение
Существуют ли способы обнулить счётчик делений клетки и остановить клеточное старение, а значит, и старение организма? В настоящее время учёные всего мира бьются над решением этого вопроса. И определённые сдвиги есть. Так, в 2009 году Нобелевский комитет присудил премию исследователям Калифорнийского университета Кэрол Грейдер, Элизабет Блэкберн и Джеку Шостаку за открытие ими в 1984 году фермента, обеспечивающего наращивание теломеры. Новое органическое вещество белковой природы получило название теломераза. Частица -аза в конце слова указывает на принадлежность к ферментам.
Одиннадцатью годами ранее, в 1973 году, существование особого вещества, способного удлинять концевые участки хромосом, предположил советский биолог, специалист Института Биохимической физики РАН Алексей Матвеевич Оловников.
Теломераза присоединяется к концу ДНК, спрятанному под теломерой, и использует его в качестве стартовой точки для добавления пар нуклеотидов и наращивания концевых участков хромосомы.
К сожалению, активно функционирующий «молодильный» фермент обнаружен лишь в трёх типах клеток человеческого организма: половых, стволовых и раковых. Остальным типам клеток не повезло: ген теломеразы в них прекращает своё функционирование уже в эмбриональный период развития, как бы выключается, и клетка даже не подозревает о его существовании.
Однако наука не стоит на месте. Учёные нашли способ заставить работать омолаживающий клетки фермент и даже встроить его ген в любую клетку. Правда, по понятным причинам массовые эксперименты пока проводились лишь на животных. Заслуживают внимания результаты исследования, организованного в 2012 году специалистами Испанского национального центра по исследованию рака. Двум группам мышей – взрослым и старым – вводили вирус, активизирующий теломеразу. Это позволило значительно увеличить продолжительность их жизни: взрослых животных – на 24 %, старых – на 13 %.
Воодушевлённая такими результатами 44-летняя глава фармкомпании из США Элизабет Пэрриш повторила опыт на себе. Ей вкололи ослабленный аденоассоциированный вирус, в который был предварительно встроен ген теломеразы. Уже спустя 6 месяцев теломеры женщины удлинились на 9 %, что соответствует омоложению тканей на 20 лет.
Однако радоваться рано: безопасность подобных экспериментов ещё не исследована. Чем они могут аукнуться в дальнейшем для здоровья человека и его потомков пока неизвестно. Некоторые специалисты предполагают, что такие опыты на людях могут закончиться увеличением количества онкологических и других смертельно опасных заболеваний. Время покажет. А пока расскажем о безопасных способах удлинить теломеры.Доступные и безопасные активаторы теломеразы
Помимо описанного выше способа пробудить теломеразу каждой клетки и заставить её встать на защиту организма человека от клеточного старения, существуют более доступные и менее рискованные пути – с помощью определённых природных веществ. Назовём некоторые из них.
Витамин D3. Если в течение 4 месяцев ежедневно принимать 50 мкг солнечного витамина, концентрация теломеразы увеличится на 20 % (H. Zhu, D. Guo, K. Li, J. Pedersen-White и другие, 2011 г.). Омега-3 жирные кислоты (эйкозапентаеновая и докозогексаеновая). Если индекс омега-3 (суммарный процент эйкозапентаеновой и докозогексаеновой кислот от общего количества жирных кислот в мембранах эритроцитов) превышает 8 %, теломераза активизируется, старение значительно замедляется (Richard Harris). Магний. Этот макроэлемент играет одну из главных ролей в процессе удвоения ДНК, обеспечивает целостность «банка данных» и при необходимости исправляет дефекты молекулы. Экспериментальным путём («Journal of Nutritional», 2011 г.) было доказано, что магний влияет на увеличение длины теломер. Фолиевая кислота (витамин В9). Тот же журнал «Journal of Nutritional» в том же 2011 году опубликовал результаты ещё одного исследования, согласно которым содержание фолиевой кислоты в плазме крови прямо пропорционально длине теломер. Витамин А. В 2011 году «Journal of Nutritional Biochemistry» обнародовал выводы исследования: витамин А крайне важен для нормальной работы иммунной системы, а потому его дефицит приводит к сокращению длины теломер. Цинк. Недостаток этого микроэлемента учёные связывают с разрывами цепочек ДНК и короткими теломерами.
Практически все перечисленные ингредиенты для омоложения организма, кроме, пожалуй, фолиевой кислоты, присутствуют в пчелопродукте, приготовленном из личинок пчелиных самцов – трутневом гомогенате. В домашних условиях сохранить этот продукт на долгое время без потери его омолаживающих свойств нереально. Однако на отечественном фармацевтическом рынке уже существуют препараты, изготовленные на основе трутневого молочка по особой технологии, позволяющей сделать это.
Профессор анатомии из Университета Калифорнии, вице-председатель Американского геронтологического общества Леонард Хейфлик, разработавший теорию старения клеток, утверждал, что максимальная потенциальная продолжительность жизни человека составляет 120 лет. Доживём ли мы до этого возраста, зависит по большей части от нас самих.