Думаю, после представления, стало понятно, почему IgG для нас идеальный вариант: они специфичны, в отличие от IgM. Для чего чего нужны антитела?
На этот вопрос Вам расширенно ответит Википедия (https://ru.wikipedia.org/wiki/Антитела), а вкратце: чтобы организм мог опознавать "чужаков".
Как получают антитела?
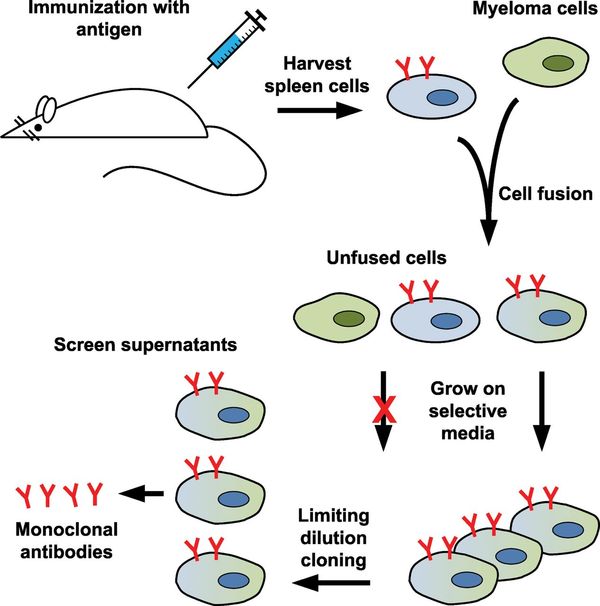
Есть такой постулат, что каждый В-лимфоцит запрограммирован на синтез антител одной определенной специфичности, относящихся к тому же типу, что и молекулы, экспрессированные на поверхности данного лимфоцита в качестве антигенных рецепторов. В настоящее время это положение убедительно доказано. Если животное иммунизируют каким-либо антигеном, то начинается клональная экспансия и дифференцировка тех В-лимфоцитов, которые распознают этот антиген. В результате образуются плазматические клетки, которые продуцируют антитела. Если бы индивидуальные антиген-реактивные клетки лимфоидной ткани иммунизированного животного удалось длительное время поддерживать в культуре, то надосадочная жидкость (супернатант (да-да)) содержала бы однородные молекулы антител (моноклональные антитела), которые были бы способны распознавать только один или несколько близкородственных антигенов.
Но есть одна проблема: лимфоциты живут не так долго, как нам бы хотелось, поэтому и напродуцировать антител они могут небольшое количество.
Решение было найдено Келером и Мильштейном, которые предложили сливать лимфоциты с наиболее живучими клетками, например, миеломой.
1) Итак, первоначальным этапом любой гибридизации является иммунизация мышей (введение антигена в организм). Существует куча протоколов иммунизаций и гибридизаций, так что я попытаюсь указать суть.
Итак, первичная иммунизация мышей проводится в полном адъюванте Фрейнда - это маслянистая жидкость с БЦЖ, которая стимулирует иммунные реакций, усиливая ответ.
Антиген+физраствор+адъювант ->взбивают суспензию и колят
Куда колят? Опять-таки, кто во что горазд: кто-то в лапы, кто-то в 6 точек (4 лимфоузла и коленки), кто-то в бедра и холку, в общем, кому и как удобно.
Следующая иммунизация проводится в неполном адъюванте, а далее кто-то начинает усиленно бустировать (колят в физрастворе/ фосфатном буфере антиген в брюхо или хвост), кто-то продолжает колоть в полном/неполном адъюванте, до достижения нужного титра антител.
2) Титр антител проверяется методом непрямого ИФА, дабы не копипастить: http://www.bialexa.ru/technical-support/methods/ELISA/
3) И вот, когда мы получили нужный титр, мы подготавливаем все для гибридизации:
а) необходимо бустировать мышь перед гибридизацией
б) необходимо приготовить планшеты, где мы в дальнейшем будем выращивать гибридомы.
В эти самые планшеты необходимо налить "фидер": так сказать среда, которая будет подпитывать первое время наши гибридомы. В качестве фидера используют селезенку здоровой мыши (спленоциты), макрофагов, крысиную сыворотку..ну, вы поняли: кто во что горазд)
в) нарастить миелому в кол-ве 35-50 миллионов.
г) подготовить среды для гибридизации (чем свежее среда, тем лучше):
- обычная стандартная RPMI-1640 или DMEM с антибиотиком;
- стандартная с большим количеством антибиотика;
- ПЭГ (для самой гибридизации)
- селективную среду (RPMI/DMEM+сыворотка плодов коровы (СПК)+ГАТ(гипоксантин-аминоптерин-тимидин))
Почему именно это сочетание: миелому клонируют и выбирают ту линию, которая дефектна по ферменту гипоксантин-гуанин-фосфорибозилтрансферазе (ГТФРТ) и отбирают на среде, содержащей тиогуанин (2-Ю-5 М). Это означает, что клетки, дефектные по ГТФРТ, не способны к синтезу ДНК, если их культивировать в среде с гипоксантином, аминоптерином и тимидином (среда ГАТ). В результате слияния с родительскими лимфоцитами этот дефект устраняется. Таким образом, только гибридные клетки способны расти на среде ГАТ.
Дабы опять не повторяться о том, что в данном деле кто и во что в качестве примера предложу рассмотреть вариант гибридизации (увы и ах, я подписала бумаги о неразглашении, так что не имею права описывать свой, но когда-то он был заботливо мной скопирован):
Непосредственно перед слиянием подготавливают следующие материалы и оборудование (в расчете на одно слияние).
1. Отбирают образец миеломы, как описано выше, и помещают 107 жизнеспособных клеток в универсальный контейнер. Оставляют при 37 °С до приготовления суспензии селезеночных клеток.
2. Шесть флаконов, содержащих по 20 мл среды RPMI-1640. Помещают в водяную баню или термостат на 37 °С.
3. Четыре флакона, содержащие по 24 мл среды RPMI-4640 с 20% СПК и пенициллином/стрептомицином. Оставляют при 37 °С с плотно закрытыми крышками, чтобы избежать защелачивания среды.
4. Два шприца на 10 мл с иглами № 23 (в каждом содержится по 10 мл среды RPMl-1640). Хранят в закрытой стерильной упаковке в ламинарном боксе.
5. Один шприц на 1 мл, содержащий 0,8 мл 50%-ного ПЭГ в среде RPMI-1640. Хранят при 37°С.
6. На столе: секундомер, 70%-ный этанол, фильтровальная бумага, пробирка для уравновешивания с 21 мл воды, водяная баня на 37 °С, стерильные инструменты, чашка Петри с 1 мл среды RPMI-1640.
7. В ламинарном боксе: пипетки, чашка Петри.
8. Две 24-луночные (объем лунки 2 мл) культуральные панели (Costar, США). Они используются без предварительной подготовки.
Процедура гибридизации
1.Забивают мышь путем дислокации шейных позвонков и обмывают тушку 70%-ным этанолом. Удаляют избыток спирта с помощью фильтровальной бумаги. Помещают мышь на анатомический столик, предварительно обработанный 70%-ным этанолом, и стерильными инструментами производят продольный разрез брюшка, чтобы обнажить селезенку. Извлекают селезенку с помощью стерильных ножниц и пинцета, помещают ее в небольшое количество среды в маленькой, стерильной чашке Петри и переносят в ламинарный бокс.
2.Обмыв селезенку средой, переносят ее в новую чашку Петри и приступают к вымыванию лимфоидных клеток, используя шприцы на 10 мл с иглой № 26 (в каждый шприц набирают по 10 мл H-RPMI —2% СПК). Вымывание производят следующим образом. При помощи одного шприца удерживают селезенку, затем производят вымывание, последовательно прокалывая небольшие участки селезенки и выпуская жидкость сначала из одного шприца, затем из другого.
3. Удаляют капсулу и строму селезенки из чашки Петри и переносят суспензию клеток пастеровской пипеткой в пробирку на 30 мл, оставляя маленькие кусочки ткани селезенки, которые могли осесть на дне чашки. Пробирку оставляют в штативе в ламинарном боксе.
Помещают 108 жизнеспособных клеток селезенки в подходящий универсальный контейнер. Вынимают контейнер с клетками плазмацитомы из термостата на 37 °С. Дважды отмывают клетки селезенки и клетки плазмацитомы в отдельных контейнерах, используя предварительно нагретую до 37 °С среду RPMI-1640. Центрифугируют при 1000 об/мин в течение 10 Мин и слегка встряхивают контейнеры, чтобы диспергировать осадок клеток, образовавшийся во время отмывания. После двух отмываний ресуспендируют клетки каждого типа в 10 мл теплой среды RPMI-1640. Вливают суспензию клеток селезенки в универсальный контейнер с клетками плазмацитомы и тщательно перемешивают клетки, осторожно переворачивая контейнер. Центрифугируют при 1500 об/мин в течение 10 мин. С помощью пастеровской пипетки полностью удаляют супернатант, оставив только осадок клеток. Слегка встряхивают контейнер, чтобы диспергировать клетки, а затем осуществляют следующие процедуры.
4. Помещают контейнер в водяную баню на 37 °С, находящуюся в ламинарном боксе, или в термостат и оставляют на 5 мин для достижения указанной температуры.
5. Помещают, вынув из термостата, наполненный, ПЭГ шприц в ламинарный бокс. Вынимают контейнер из термостата на 37 °С и слегка /встряхивают для перемешивания и распределения осадка клеток по коническому дну контейнера.
4. Через 1 мин добавляют в контейнер 0,8 мл ПЭГ. Вращают контейнер в наклонном положении, чтобы обеспечить равномерное распределение клеток и ПЭГ по коническому дну контейнера.
5. Оставляют контейнер на одну мицуту при 37 °С в водяной бане или в обычном термостате.
6. Через 1 мин добавляют по каплям 1 мл среды RPMI-1640, нагретой до 37 °С.
7. Через 5 мин медленно добавляют 20 мл теплой среды RPMI-1640.
8. Центрифугируют клетки, при 1500 об/мин в течение 15 мин, используя для уравновешивания пробирку с 21 мл воды.
9. Удаляют/супернатант и добавляют к осадку клеток 24 мл теплой среды RPMI-1640 с 20% СПК и антибиотиками. Закрывают контейнер крышкой, а затем, вращая его, ресуспендируют и диспергируют осадок клеток.
10. Подготавливают и надписывают две 24-луночные планшеты для культуры. Используя градуированную пипетку или диспенсер на 1 мл, снабженный стерильным наконечником, добавляют по 0,5 мл суспензии клеток в каждую из 48 лунок.
11. Добавляют в каждую лунку по 1,5 мл теплой среды RPMI-1640 с 20% СПК и антибиотиками. Переносят планшеты в термостат с регулируемым составом атмосферы и увлажнением.
Если надо, то расскажу, что происходит дальше, а сейчас на этом все)
Рада буду ответить на вопросы)
И вдвойне рада, если вы дочитали до конца и не уснули)
Всем добра^^