Очень легкая химия (почти) ep 8
Данная тема в отличии от предыдущих имеет не сколько фундаментальный, сколько прикладной характер, без знаний о фазовых равновесиях сложно предсказать ход синтеза при высоких температурах, представьте, что вещество, которое должно реагировать вдруг испарилось) Из-за этого страдает и выход продукта и оборудование, которое может быть не рассчитано на такой поворот событий.
Изучая эту тему необходимо знать, что химики подразумевают под фазой.
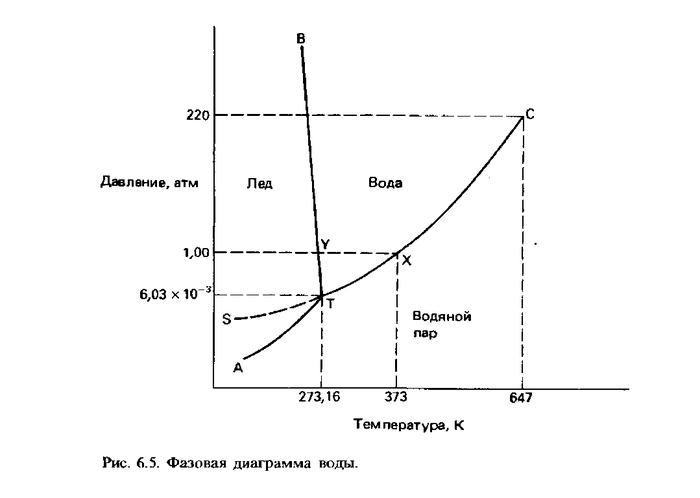
Фаза- вещество или раствор, все составные части которого описываются одним и тем же уравнением состояния. Возьмем в качестве примера стакан с водой, здесь в равновесии находятся две фазы водяной пар и жидкая вода. Повышая давление, мы смещаем давление в сторону жидкой воды в соответствии с принципом Ле Шателье, равновесие фаз одного вещества можно представить в виде фазовой диаграммы. Вот пример для воды.
Говорить о разовых диаграммах можно и нужно долго, но я затрону лишь несколько моментов. Фазовая диаграмма показывает, в какой фазе находится то или иное вещество при определенных условиях (температуре и давлении). На диаграмме мы сразу же видим ее корреляцию с принципом Ле Шателье, вода может оставаться в жидком состоянии и при температуре выше 100 градусов. Но это не самое интересное, линии, которые разделяют фазы отвечают состояниям равновесия, когда две фазы сосуществуют. Также можно заметить, что существует точка, где эти линии пересекаются, она называется тройной точкой (T) и имеет большое значение, так как выполняет роль своеобразной точки отсчета, ведь на всей диаграмме существует только одна тройная точка. В ней наблюдается весьма интересное явление: жидкость одновременно кипит и кристаллизуется)
Говоря о точках на фазовой диаграмме, нельзя не сказать про критическую точку (C), в ней вещество находится в газовой фазе и его невозможно сконденсировать ни при каком давлении. Кроме того, резко изменяются и другие физические характеристики вещества, что нельзя не учитывать, проводя синтез вблизи критических значений.
По-настоящему широкое применение нашли фазовые диаграммы двухкомпонентных систем, именно их используют при проведении неорганического синтеза. Отличие диаграмм однокомпонентных систем от двухкомпонентных состоит в том, что последнии представлены в виде трехмерных диаграмм, так как фаза будет зависеть еще и от состава смеси. Поскольку трехмерная система не очень наглядна обычно используют сечения или проекции диаграмм. Если говорить о применении, то самым наглядным будет пример с металлургией: фазовая диаграмма системы железо-углерод показывает какую температуру нужно использовать для обработки стали, чтобы получить необходимые физические свойства.
На самом деле, соединения внедрения встречаются нам чаще, чем мы думаем, принцип обработки стали основан на превращениях, связанных с внедренным в структуру железа углеродом. Железо при нагревании до большой температуры переходит из альфа состояния в гамма, и углерод, сплавленный с железом, располагается равномерно по кристаллической решетке. Если сталь охлаждать медленно, углерод успеет связаться в кристаллы карбида железа, или цементита, и сталь станет мягкой, если же гамма железо охладить быстро, углерод останется в решетке, и атомы железа плотнее сожмутся вокруг него, что повысит твердость и прочность стали, это и называется закалкой.
Не легкая химия (почти) ep1
Также теория о фазовых равновесиях используется в изготовлении эвтектического сплава, то есть насыщенного относительно двух компонентов и представляющего смесь из очень мелких кристалликов веществ. В тоже время неэвтектический сплав представляв собой неоднородную смесь, с вкраплениями кристаллизовавшихся из перенасыщенного сплава компонентов, что может негативно сказаться на выходе продукта. Именно эвтектический сплав криолита и глинозема (Na3AlF6 и Al2O3) используют для производства алюминия (электролитические свойства такого сплава лучше чем у чистого Al2O3 за счет чего уменьшаются потери энергии в процессе электролиза)
Еще важно знать как плавится некоторое вещество, например многие карбонаты при нагревании разлагаются, и нельзя не учитывать это в ходе синтеза. Поэтому было введено еще одно понятие: конгруэнтное и инконгруэнтное плавление. Да словечки так себе, но всё довольно понятно: конгруэнтным называют плавление вещества при котором состав жидкой и твердой фазы одинаков, например плавление воды или хлорида натрия, а вот многие кристаллогидраты плавятся инконгруэнтно, то есть их состав изменяется, из их координационной сферы выходит вода.
Уже сейчас видно насколько большое практическое применение имеет эта теория, однако это еще не все. Говоря о бинарных соединениях часто упоминают область гомогенности, отклонение от стехиометрического состава соединения, это явление характерно для оксидов, бинарных соединений металла и неметалла, сплавов, бывает, что область гомогенности не включает в себя соединение с стехиометрическим составом, например оксид железа 2 с формулой FeO всегда имеет дефицит железа. Подобные соединения (не отвечающие стехиометрической формуле) называют бертоллидами, а те, что отвечают, дальтонидами.