Очень легкая химия (почти) ep 7
Коллоидная химия, довольно часто встречается нам в повседневной жизни, уже скоро начнется пора гололеда и слякоти, а у кого-то уже началась, в это тяжелое время дороги посыпают всеми нелюбимой "солью", вам думаю интересно, что это за соль и зачем ею обильно орошают проезжую часть и тротуары. Собственно ничего удивительного тут нет, эта "соль" самая что ни на есть обычная поваренная соль, хлорид натрия, галит, и посыпают ею с благой целью, растопить избыток снега, стоп, как соль может растопить снег, на этот и похожие вопросы мы сегодня постараемся ответить.
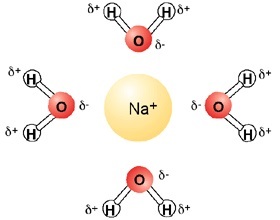
Начнём с теории растворимости, как мы знаем в полярных растворителях вроде воды растворение происходит путем сольватации ( образование "шубы" вокруг ионов или полярных молекул) это происходит потому что молекула воды полярна, и образование сольватированного ( укутанного "шубой") иона с энергетической точки зрения более выгодно чем существование ионной ( а иногда и ковалентной связи) в растворе. Так вот, процесс замерзания это образования кристаллической решетки льда, и так получается, что воде выгоднее связываться с ионами, чем встраивается в кристаллическую решетку, а следовательно менять положение полюсов, относительно заряженного иона, конечно это не уменьшает температуру замерзания на десятки градусов, но парочки можно добиться без особых усилий. Именно поэтому коммунальщики так любят соль.
Вы заметили, что при описании теории, кроме наличия ионов в растворе и упоминания растворителя (воды) я больше ничего не сказал. В этом и прелесть коллоидной химии- на коллигативные свойства расстворов влияют только природа растворителя и колечство сольватированных частиц. Если не поняли, изменение температуры кристаллизации, одно из так называемых коллигативных свойств расстворов, к ним относится еще
Изменение температуры испарения
Осмотическое давление
Изменение давления пара над жидкостью
С изменением температуры кипения всё почти также как и со снегом, сольватированные ионы "не отпускают" молекулы воды и растворитель кипит при большей температуре, поэтому бросая щепотку соли в кипящую воду, она на некоторое время перестает кипеть.
Теперь самое вкусное, осмотическое давление, именно оно позволяет солить огурцы и помогает нам дышать, дело в том, что эритроциты (те что с гемоглобином) очень чувствительны с изменнию солености крови, при её увеличении или уменьшении, они разбухают и закупоривают сосуды. Пожтому в качестве основы для капельниц нельзя использовать дистиллированную воду, вместо нее применяют физраствор, раствор солей, соответствующий солености крови. Так как же работает осмотическое давление, рассмотрим два сосуда, соединенные полупроницаемой мембраной, она не пропускает соли, но пропускает настворитель, в пераом сосуде крепкий раствор соли, во втором дистилят, мы заметим, что мембрана выгибается в сторону с большей соленостью, это происходит потому что вода из сосуда с дистилятом стремится сольватировать ионы в первом сосуде, этот процесс ( переход через мембрану и сольватация) энергетически выгоден. Таким образом, поток жидкости, уравношенный обратным потоком всвязи с диффузией, создает давление на мембрану и она выгибается. Как я уже сказал, этот процесс использовался человечеством с древнейших времен для консервации продуктов.
А вот изменение давления пара над раствором не самая интересная тема, о ней покороче, был один мужик, Рауль, закон он сформулировал, теория его была такова, что на поверхности жидкости, откуда непроизвольно испаряется вода, из-за наличия в растворе ионов, становится меньше молекул воды (некоторые из них заменяются ионами) следовательно испаряется меньше воды, следовательно давление пара меньше.