Очень легкая химия (почти) ep 5
Вы никогда не задумывались почему при окислении перманганатом в кислой среде получается именно Mn2+, почему хлор может диспропорционировать в воде, как вообще предсказать поведение вещества в конкретной реакции. Это конечно же может объяснить термодинамика, энергия Гиббса, и некоторые законы кинетики, однако намного более практичным будет способ, о котором мы сегодня поговорим.
Начнем с того, что такое потенциал, и отчего он возникает.
Исходя из знаний русского языка потенциал- это возможность взаимодействия. Что же может взаимодействовать, вещества скажете вы, но не все так просто, речь идет о физичеком взаимодействии, а именно об электростатическом. Представим медную пластинку в стакане с водой, часть атомов меди ионизируются и переходят в раствор, этому способствует, с точки зрения термодинамики, увеличение энтропии ионов(беспорядка). Следовательно в растворе оказывается избыток меди+ и частичный положительный заряд, а в металле избыток электронов, то есть частичный положительный заряд, правда есть одна проблема, его невозможно измерить.
Однако, если не пропускали физику в школе, вы наверное помните, что такое разность потенциалов, да да, это напряжение на электродах гальванического элемента, так собственно измеряют электрохимический потенциал определенной пары, например Mn2+/ MnO4-, за 0 значение принят потенциал пары 2H+/H2, но водородный элемент очень громоздкий и дорогой, поэтому используют хлорсеребряный элемент, электрохимическим потенциалом 0.23.
Так что же нам делать с этой информацией, огромное количество значений не создают цельной картины, и врядли смогут чем то помочь химикам. Поэтому создано несколько способов наглядно представить эту информацию:
Электрохимические пары
Ряды Латимера
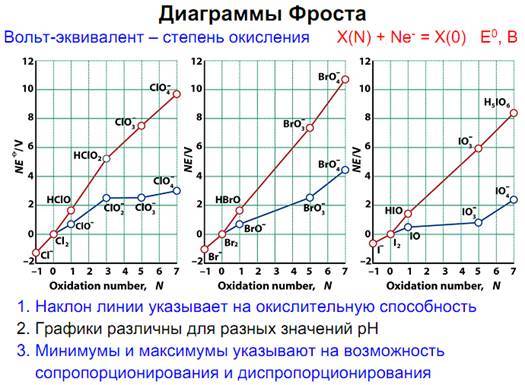
Диаграммы Фроста
О последних, ввиду их наибольшей интересности и поговорим.
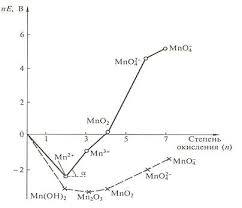
Перед вами диаграмма Фроста для марганца, как вы видите это график зависимости относительного электрохимического потенциала и степени оксисления элемента.
Что же с помощью него можно сделать, например узнать самую стабильную форму элемента, у марганца в кислой среде это Mn2+, а в щелочной Mn2O3, если вы заметили, они оба расположены ниже всех других форм, эти продукты и получаются при окислительно-восстановительных взаимодействиях.
Также можно заметить, что точки располагаются совсем не на одной прямой, такое расположение позволяет предсказать некоторые возможные реакции, например если мы проведем линию через Mn02 и Mn04-, то заметим, что Mn04 2- это означает, что эта форма марганца склонна к диспропорционированию, т.е MnO4 2- может распасться на MnO4- и MnO2, данное превращение происходит и на практике, марганцоватая кислота распадается до марганцовой и оксида марганца 4. Так же и с случаями когда форма оказывается под линией, соединяющей соседние. Ярким примером является йод, а именно реакция копропорционирования йодида и йодата до йода, такое превращение можно легко предсказать по диаграмме.
Также с помощью диаграмм Фроста можно сравнивать окислительтные и восстановительные способности соединений разных элементов в одной степени окисления, например серы и селена, определять степени окисления элемента, например в смешанных халькогенидах, например соединения серы и теллура. Эти знания мы и сами того не подозревая использовали, когда смотрели на положение металла относительно водорода в электрохимическом ряду напряжений, чтобы узнать, вытесняет ли он водород из кислоты.
Теория об окислительно-восстановительных потенциалах, позволяет лучше понять, как происходят те или иные превращения, так мы можем заглянуть внутрь механизма, который доселе был нам не очевиден.
Автор немного переборщил с серьезностью, не бейте пж)
Что-то я по жести пошёл, следующие посты будут по физхе, раскажу про энтальпию, энтропию, всё-таки легкую химию учим.