Водород и всё-всё-всё – ч. 2.1: нуклиды (атомный номер и избыток нейтронов)
Итак, рассмотрим основные характеристики нуклидов.
Как известно, ядро атома образуют два типа частиц: протоны (p или p⁺) и нейтроны (n или n⁰). Соответственно, нам понадобится два базовых показателя, характеризующих состав ядра атома: число протонов (Z) и число нейтронов (N). Почему число нейтронов обозначается символом N, думаю, понятно, а вот по поводу символа Z поговорим отдельно.
Те, кто знаком с обозначениями числовых множеств, сразу же признает в Z обозначение множества целых чисел ℤ – и будет совершенно прав. Как символ ℤ происходит от нем. Zahlen (/ˈtsaːlən/, цален) – "номера", "числа", так и символ Z означает Zahl – "номер", т.е. буквально "номер, под которым элемент значится в периодической таблице". Это обозначение появилось ещё тогда, когда о строении ядра ничего не было известно, а элементы в таблице просто упорядочивались по атомному весу. И только после 1915 года, когда выяснилось, что номер элемента совпадает с зарядом ядра атома, термин расширили до Atomzahl, оставив обозначение прежним: Z. Теперь мы также знаем, что заряд ядра атома равен числу протонов в ядре, поэтому все эти термины являются синонимами:
– порядковый номер;
– атомный номер;
– атомное число;
– зарядовое число;
– число протонов.
(также атомному номеру равно число электронов в нейтральном атоме).
Здесь необходимо заметить, что на практике число нейтронов N обычно не используется для описания нуклида, а вторым по важности после атомного номера Z является массовое число A – суммарное количество протонов и нейтронов: A = Z + N. Для символа здесь также использовано немецкое слово: Atomgewicht – т.е. буквально "атомный вес". Такой выбор термина вполне оправдан, т.к. массовое число приблизительно равно атомной массе нуклида (выраженной в атомных единицах массы).
Мы перечислили уже три характеристики нуклида, а вы пока ещё не услышали для себя ничего нового. Введём четвёртую характеристику: избыток нейтронов. Вполне логично, что если у нас имеется сумма числа протонов и нейтронов, то должна быть и разность: D = N – Z. Символ D здесь обозначает difference number. Исторически этот показатель также называют изотопическим числом (isotopic number) и альтернативно обозначают символом I.
Итак, у нас имеется четыре характеристики нуклида:
– число протонов Z
– число нейтронов N
– массовое число A = Z + N
– избыток нейтронов D = N – Z
Образуем из них символ нуклида.
Атомный номер Z, по сути, является синонимом символа элемента и факультативно указывается в левом нижнем углу:
То есть выражения "водород", "первый элемент", H и ₁H все обозначают одно и то же – химический элемент водород. Сам по себе атомный номер никакой дополнительной смысловой нагрузки не несёт и часто опускается (т.к. символа элемента вполне достаточно).
А вот массовое число A уже характеризует конкретный нуклид и именно оно обычно и участвует в описании нуклида в тексте. Массовое число указывается в левом верхнем углу самостоятельно:
либо вместе с атомным номером:
Последний вариант обозначения является так называемой стандартной AZE-нотацией: массовое число A – атомный номер Z – символ элемента E. Приведём несколько примеров для первых элементов таблицы:
Но чаще в тексте нуклид указывается только с массовым числом, причём возможны следующие комбинации: углерод-12, C-12, ¹²C – всё это обозначает самый распространённый нуклид углерода.
Итак, символ элемента (E) и массовое число (A) фактически однозначно определяют нуклид.
Число нейтронов N обычно самостоятельно не указывается, а присутствует в описании символа нуклида только вместе с атомным номером Z (и массовым числом A):
Это так называемый полный символ нуклида:
Как вы можете убедиться, сумма двух нижних индексов (Z + N) равна верхнему левому индексу (A).
А как же четвёртый показатель – избыток нейтронов D? Дело в том, что он, по сути, является избыточным и ничего нового к описанию нуклида уже не добавляет, поэтому не используется практически никогда. Вы вряд ли сегодня найдёте о нём много информации (а также о его синониме: изотопическом числе I – если только вы не знакомы с англоязычной литературой столетней давности: примерно тогда этот термин и был введён). Тем не менее (т.к. у нас имеется ещё одно вакантное место для индекса) в учебных целях вы можете указать его в верхнем правом углу:
Впоследствии это нам ещё пригодится. Если вы рассчитаете избыток нейтронов для приведённой выше цепочки нуклидов, то получите:
Как вы можете заметить, в двух случаях (¹H и ³He) избыток нейтронов отрицателен и равен (–1). У трёх нуклидов число протонов и нейтронов одинаково и избыток нейтронов равен 0: ²H, ⁴He, ⁶Li – это нуклиды с чётным массовым числом, равным удвоенному атомному номеру: A = 2Z. Также нам встречаются нуклиды с положительным избытком нейтронов, равным 1: ³H, ⁷Li, ⁹Be – у них в ядре нейтронов на 1 больше, чем протонов.
Разберём все три случая.
1. Отрицательный избыток нейтронов у стабильных нуклидов встречается всего дважды, и оба эти нуклида мы уже перечислили. Это лёгкий нуклид водорода – протий ¹H (его ядром является протон) и лёгкий нуклид гелия ³He (его ядро называется гелион – заметьте, именно ядро). Все остальные стабильные нуклиды имеют нулевой или положительный избыток нейтронов (и чем ближе к концу таблицы, тем более положительный).
2. Нулевой избыток нейтронов встречается у стабильных нуклидов до кальция включительно. Знать такие нуклиды может быть очень полезно, т.к. это позволяет быстро в уме оценить атомную массу элемента (конечно, тем, кому такие навыки в принципе могут пригодиться).
Разберём несколько практических задач. Во-первых, среди четырёх основных органообразующих элементов – CHON ("чён") – три элемента (кроме водорода) представлены в природе в основном стабильными нуклидами с нулевым избытком нейтронов: ¹²C, ¹⁴N, ¹⁶O. Если в школе вы выучили хотя бы первые три периода таблицы на память (как считалочку), то вам не составит труда вспомнить атомный номер элемента Z, посчитать его массовое число A = 2Z и определить атомную массу:
Z = 6, A = 2·6 = 12 – для углерода ₆C
Z = 7, A = 2·7 = 14 – для азота ₇N
Z = 8, A = 2·6 = 16 – для кислорода ₈O
Конечно, всё это очень простые, элементарные вещи, но теперь вы можете объяснить, почему у этих элементов такие красивые круглые (и чётные!) атомные массы.
Но где всё это в принципе может пригодиться? Ну, например, вы хотите посчитать среднюю молекулярную массу воздуха. Вы прекрасно помните, что воздух состоит из азота N₂ (80%) и кислорода O₂ (20%). Даже если вы забудете про кислород, а возьмёте 100% азота , ваша оценка уже будет очень близкой к реальности:
M(возд.) = M(N₂) = 2·14 = 28 г/моль.
Добавив кислород, вы получите:
M(возд.) = 0.8·2·14 + 0.2·2·16 = 28.8 г/моль
Это уже очень хорошая оценка (учёт аргона и углекислого газа сильно её не изменит).
Но для чего же нам может понадобиться средняя молекулярная масса воздуха? Например, с её помощью вы сможете оценить, где будет скапливаться газ, идущий из открытой, но незажжённой горелки.
Для этого нам потребуется молярная масса природного газа – метана CH₄:
M(CH₄) = 12 + 4∙1 = 16 г/моль
и сжиженного газа – пропана C₃H₈:
M(C₃H₈) = 3∙12 + 8∙1 = 44 г/моль.
Всё это мы уже умеем считать в уме.
Как видно из расчётов, метан (идущий по централизованной трубе) почти в 2 раза легче воздуха и быстро выветривается через открытую форточку (а если форточка закрыта, то через вентиляцию). Пропан же (привезённый в баллоне) в 1.5 раза тяжелее воздуха и никуда не выветривается, а скапливается слоем внизу комнаты и быстро вспыхивает от искры непредусмотрительно нажатого настенного выключателя (к тому же взрывоопасность пропана в 2 раза выше, чем у метана, и ему нужна меньшая концентрация для взрыва). Насколько эта информация может быть полезна? – Думаю, может. Например, она может вам подсказать, что вентиляция на кухне всегда должна быть открыта и исправна. И тогда всё будет в порядке.
3. Мы уже освежили в памяти довольно большой объём информации, но рассмотрим кратко последний пункт и вспомним про элементы с положительным избытком нейтронов (таких элементов в периодической таблице большинство).
Из полного списка шести органообразующих элементов – CHONPS ("чёнпс") – два последних (фосфор и сера) по этому признаку отличаются. Фосфор ₁₅P – единственный из списка, имеющий положительный избыток нейтронов D = 1 (нуклид ³¹P), а сера ₁₆S присоединяется к углероду, азоту и кислороду и представлена в основном нуклидом ³²S с нулевым избытком нейтронов.
На этом пока всё. Продолжим в следующей части, где мы разберём типы нуклидов и узнаем, что же это за зверь такой – изодиаферы, а также познакомимся с зеркальными ядрами и ядерными изомерами.


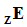
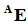
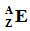
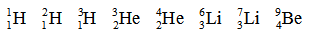
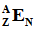
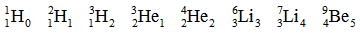
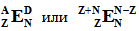
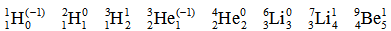
Наука | Научпоп
7.7K поста78.5K подписчиков
Правила сообщества
Основные условия публикации
- Посты должны иметь отношение к науке, актуальным открытиям или жизни научного сообщества и содержать ссылки на авторитетный источник.
- Посты должны по возможности избегать кликбейта и броских фраз, вводящих в заблуждение.
- Научные статьи должны сопровождаться описанием исследования, доступным на популярном уровне. Слишком профессиональный материал может быть отклонён.
- Видеоматериалы должны иметь описание.
- Названия должны отражать суть исследования.
- Если пост содержит материал, оригинал которого написан или снят на иностранном языке, русская версия должна содержать все основные положения.
Не принимаются к публикации
- Точные или урезанные копии журнальных и газетных статей. Посты о последних достижениях науки должны содержать ваш разъясняющий комментарий или представлять обзоры нескольких статей.
- Юмористические посты, представляющие также точные и урезанные копии из популярных источников, цитаты сборников. Научный юмор приветствуется, но должен публиковаться большими порциями, а не набивать рейтинг единичными цитатами огромного сборника.
- Посты с вопросами околонаучного, но базового уровня, просьбы о помощи в решении задач и проведении исследований отправляются в общую ленту. По возможности модерация сообщества даст свой ответ.
Наказывается баном
- Оскорбления, выраженные лично пользователю или категории пользователей.
- Попытки использовать сообщество для рекламы.
- Фальсификация фактов.
- Многократные попытки публикации материалов, не удовлетворяющих правилам.
- Троллинг, флейм.
- Нарушение правил сайта в целом.
Окончательное решение по соответствию поста или комментария правилам принимается модерацией сообщества. Просьбы о разбане и жалобы на модерацию принимает администратор сообщества. Жалобы на администратора принимает и общество Пикабу.