Почему растворяются болты, гальваническая коррозия
Почему нельзя просто так взять, и соединить два металла? А вот почему:
Эти болты крепили латунную фурнитуру бачка, вот такую:
Вот так это выглядело - головка болта растворилась:
Итак, почему это произошло, как этого можно было избежать? Пикабу образовательный, я очень надеюсь что многие не узнают для себя ничего нового, но кто-то освежит свои познания в школьной химии.
В школе, в кабинете химии у многих над доской висел ряд напряженности металлов, вот этот:
Li K Sr Ca Na Mg Al Zn Cr Fe Cd Co Ni Sn Pb H Cu Ag Hg Pt Au
Металлы в этом ряду отсортированы по мере убывания электроотрицательности (относительно водорода, он принят за условный ноль). Что это значит на практике:
1. Если два металла контактируют (образуют гальваническую пару) в воде, то разрушается тот, который в ряду левее.
2. Чем дальше друг от друга металлы в ряду, тем интенсивнее процесс гальванической коррозии.
Итак, что же произошло. Болт стальной, из железа (Fe). Фурнитура из латуни, сплав меди с цинком (основную роль в процессе сыграла медь - Cu). По ряду видим, что они далеко друг от друга, и железо левее, а значит в этой паре будет разрушаться болт.
Рассмотрим другой пример для понимания - оцинкованную жесть и луженую жесть. Оцинковка конструкций используется для защиты железа от коррозии - цинк левее железа в ряду напряженности, а значит, если оцинкованная конструкция будет поцарапана, то в месте царапины начинает разрушаться цинк, и пока весь цинк не разрушится, железо ржаветь не начнет.
С луженой жестью (консервная банка тому пример) ситуация в точности наоборот. Олово (Sn) в ряду правее железа, а значит в этой паре в месте царапины будет разрушаться железо! до тех пор, пока не останется тонкая скорлупка из оловянного покрытия.
Покрыть слой металла другим, более электроотрицательным "жертвенным" металлом - один из приемов борьбы с коррозией - позволяет выиграть дополнительные годы эксплуатации, оцинкованный лист железа прослужит дольше просто стального.
Так как же должен был поступить грамотный сантехник, чтобы избежать такого эффектного растворения болтов?
Первый вариант - использовать латунные болты. Они дороже стальных, но не образовали бы гальванической пары. Нержавеющие болты бы тоже не спасли - посмотрите где хром и никель (основные добавки, делающие сталь нержавеющей) относительно меди.
Второй вариант - диэлектрическая прокладка. Если металлы контактируют меж собой через диэлектрическую прокладку, то электрической цепи не образуется, электрохимическая коррозия не протекает. При соединении медного трубопровода со стальным она обязательна, вот на фото помечена как "plastic liner":
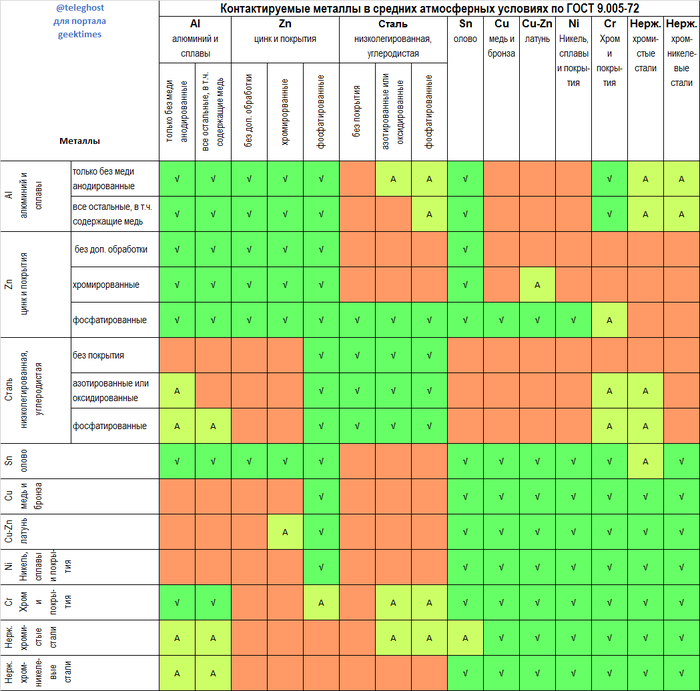
Для удобства и точности инженеры уже подумали и составили ГОСТ 9.005-72, который описывает как раз, какие металлы в паре коррозируют слишком быстро, а какие можно меж собой скручивать/покрывать. Вот так выглядит таблица:
ГОСТ прочитал и свел в красивую табличку пользователь teleghost на хабре (https://habr.com/ru/post/398957/). Еще можно скачать экселевскую табличку тут: https://dwg.ru/dnl/14039
Теперь вы знаете, почему крепить стальную табличку на медные заклепки - плохая идея.