И ароматом впечатляет, и на лабораторном столе сияет
Нужных ионов вам, уважаемые подписчики сообщества и читатели! Поскольку я в силу обстоятельств специализируюсь на реакциях, которые легко могут быть повторены в домашних условиях, сегодня вы увидите небольшой пост об одном обыденном соединении. Наврядли найдется человек, который не знал бы его запаха и его применении. Речь пойдет о ванилине.
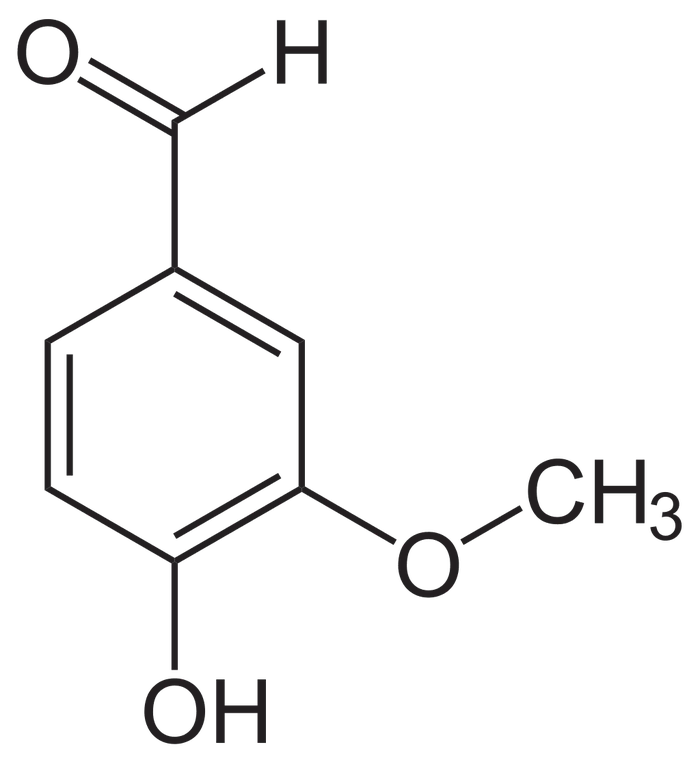
С точки зрения химии, ванилин является двусмысленно ароматическим альдегидом, содержащим, однако, еще и эфирную и фенольную функциональные группы. Логично было бы полагать, что соединение это весьмацки реакционноспособное даже в условиях "наколенных" лабораторных условий. Кстати говоря, практическое применение у ванилина ограничивается, в основном, пищевым производством, в коем наш альдегид приобрел популярность за счёт неповторимого и сильного аромата. Находчивые и смекалистые смогли приспособить ванилин также в фармацевтике, в работе с металлами и репеллентами, правда, это факты куда менее известные. В связи упомянутым многие химики, в том числе и домашние, нередко могут обходить стороной это примечательное вещество. А посему если в пределах досягаемости у вас несколько бытовых реактивов и вам нечем заняться, то вы можете углубиться в природу свойств нашего ароматизатора.
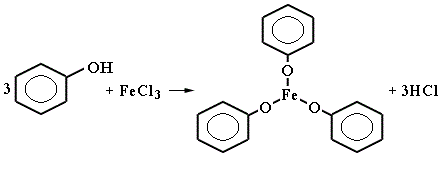
Когда я только начал собирать отовсюду свой суровый набор реактивов, я очень увлекался солями железа (III). Одним из самых красочных взаимодействий можно назвать их реакцию с фенольными гидроксилами (ФГ), в результате чего образуются окрашенные продукты в виде комплексов. В зависимости от веществ с ФГ цвет продукта может резко варьироваться, от зеленого до синюшно-фиолетового. Ванилин, как мы уже увидели, тоже счастливчик с одной ФГ-шкой, а значит реакция должна пройти успешно.
В качестве источника нужного нам комплексообразователя отлично подходит безводный хлорид железа (III). Суровым технарям известен как реактив, растворяющий медь для травки печатных плат. Маркий, едкий. Этикетка предупреждает, что безводная соль растворяется в воде с выделением тепла, осторожно!
Обычный магазинный порошковый ванилин, к счастью, отлично растворяется в воде, так что трудностей с растворителем у вас не возникнет. Понемногу приливаем хлорид к р-ру ванилину и наблюдаем:
С первыми каплями хлорида железа бесцветный р-р ванилина тут же темнеет, окашиваясь в насыщенный фиолетовый.
Повтор. Здесь лучше видно, как переходят цвета, а то вы подумаете, что я просто прилил фиолетовый краситель.
Реакция, конечно, имеет больше аналитический характер, однако над ее механизмом надо еще подумать. Разные соотношения количеств хлорида и вещества с ФГ приводят к различным по строению продуктам. Иногда ион железа может связать три молекулы исследуемого вещества, а иногда даже шесть. Применимо это в первую очередь, к фенолу.
Обычно по запросу "реакция фенола с хлоридом железа 3" выходит именно этот случай. Полагаю, наиболее уместным будет считать, что комплекс содержит все-таки три связанных молекулы ванилина.
Полученный комплекс, кстати, легко разрушается щелочами, например, гидроксидом натрия:
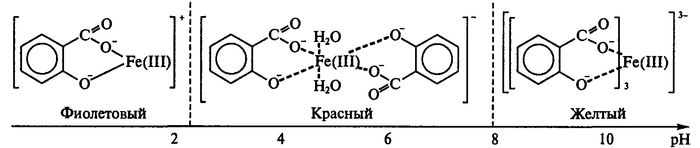
Щелочь быстро и охотно воздействует на только что образовавшийся комплекс. Самым логичным выводом было предположение, что происходит разрушение комплекса. Вскоре я нашел вот это изображение, где подобные громоздкие соединения с другими веществами, например, с ацетилсалициловой кислотой в разных рН меняют свой окрас вследствие перестройки самого комплекса:
К кислотам р-р флегматичен, они помогают комплексу вернуть свой приятный цвет при нейтрализации щелочной среды и дальнейшем понижении рН:
Подщелачиваем, комплекс нервничает и светлеет, затем подкисляем, и он успокаивается, возвращаясь в исходное состояние.
А здесь окрашенный испытуемый встретился с обоими реагентами, но в обратном порядке.
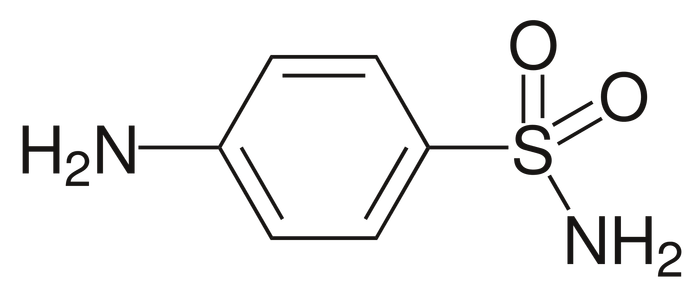
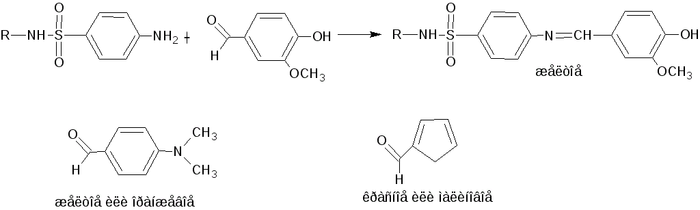
Если вы не открывали и не читали фармакопеи, то это не значит, что вы не могли знать этой реакции. Да, отличительной особенностью ее считается тот факт, что применяется она чаще при испытаниях на подлинность, качественных анализах препаратов, содержащих аминогруппу при ароматических соединениях. Таковыми можно назвать, например, стрептоцид из класса сульфаниламидов, старых добрых антисептиков. Одной из таких реакции обнаружения является связывание стрептоцида и ванилина в так называемое основание Шиффа.
Строение белого стрептоцида, классического сульфаниламида.
Лучше картинки не нашел, но здесь все видно: реакция идет через нуклеофильное присоединение амина (стрептоцида) к углероду альдегидной группы ванилина с образованием нестойкого 1,1-аминоспирта с последующей его дегидратацией до имина.
Скучно выглядит? Не вопрос:
Присыпаем сухой ванилин к р-ру стрептоцида и ждем, пока р-р не пожелтеет. Нагревания не требует, хотя и пойдет так быстрее.
С помощью цветофильтров усиливаем окрас для наших чутких к правде глаз. Слева - основание Шиффа, справа - контрольный р-р.
С ванилином можно прогреть р-р окисленного р-ра валидола, так тоже будет вам радость в виде желтого продукта. О его природе надо пилить еще лабораторные работы, там все сложно.
Ванилин легко окисляется, для этой простой задачи нужно не большее, чем перманганат калия, марганцовка, одним словом. Процесс столь быстр, что протекает в нейтральной среде без проблем.
Перманганату тут есть что потрогать: на уговоры его ведется альдегидная группа, окисляющаяся до бензоата калия, возможно, реакция идет и по ФГ, где есть вариант окисления до хинонов. Продукты имеют бурый окрас, марганец восстановился с 7+ до 4+, выйдя в виде нерастворимого диоксида.
Окисляется ли ванилин иодом? Точный ответ дать непросто, ведь ему вроде и негде пристроиться, однако практические испытания демонстрируют легкое обесцвечивание реактива. Хотя на самом деле это могут быть виноваты и примеси. Окислить карбонильную группу до карбоксильной иоду вряд ли хватит сил.
Вот такой краткий экскурс по самым доступным хим. свойствам ванилина. Повторяйте, изучайте, действуйте. Все выводы, как и всегда, делайте сами.
Спасибо за то, что всё ещё читаете эти довольно дилетантские попытки заинтересовать вас химией :)






Лига Химиков
1.6K поста12.5K подписчиков
Правила сообщества
Старайтесь выбирать качественный контент и не ставьте теги моё на копипасты
Посты с просьбой решения домашнего задания переносятся в общую ленту
Также нельзя:
1. Оскорблять пользователей.
2. Постить материал далеко не по теме и непотребный контент (в остальном грамотно используйте теги)
3. Рекламировать сомнительные сайты и услуги коммерческого характера