Такой разный карбамид: 10 интересных фактов о мочевине
Мочевина впервые была обнаружена и названа в конце XVIII века (1773 год) химиком-французом Илером Мареном Руэлем. Изучаемой субстанцией, в которой находилось искомое вещество, была моча осла. Спустя 6 лет учёные Л. Воклен и А. Фуркуа более подробно провели изучение выделенного соединения и присвоили другое название: карбамид (подразумевалось – амид угольной/карбоновой кислоты, от латинского “carbon”– углерод). Оно осталось таким вплоть до современности. Но опыты были несовершенными, и в чистом виде получить вещество никак не удавалось. Только спустя 30 с лишним лет – в 1808 году – осуществить это смог Й.Я. Берцелиус.
Состав и химико-физические свойства карбамида
Интересный факт № 1
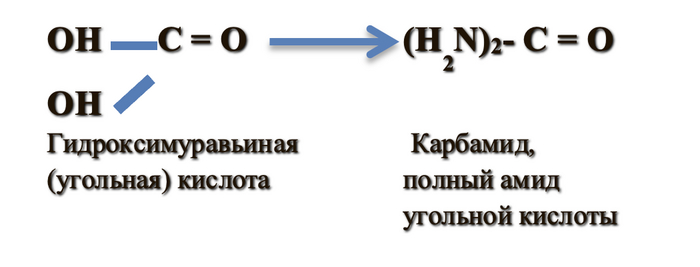
Карбамид является производным соединением угольной кислоты и одновременно производным соединением гидроксимуравьиной кислоты. И все же, карбамид - органическое или неорганическое соединение?
Это органическое соединение, полученное путем проведения химических реакций из неорганических веществ. Карбамид (мочевина) – это химическое соединение, которое представляет собой белые кристаллы. Они не имеют характерного запаха. Растворимость в воде и других полярных растворителях – высокая. Соединение относится к 3 классу опасности по экологической систематике влияния веществ на здоровье человека (умеренно опасное, нетоксичное соединение). Химическая формула мочевины: H2N-CO-NH2 (диамид угольной кислоты). Массовая доля азота составляет 46%. Это стратегическое значение позволяет назвать мочевину самым концентрированным и насыщенным удобрением по содержанию азота. Оно решает тему азотного дефицита очень быстро и эффективно. Его ценность в том, что вещество подходит для использования на любых почвах и для любых агрокультур.
Интересный факт № 2
Плюсы использования мочевины (карбамида):
• усваиваемая растениями химическая форма;
• полностью расходуется, не содержит лишних массовых примесей;
• отличный эффект создаёт внесение разведённой мочевины при поливе – усвоение пройдёт лучше (действенно для растений, которым требуется «скорая по-мощь» в отношении азота);
• осуществляет регулировку роста вегетативной массы;
• содержание белка в плодах увеличивается;
• повышается урожайность.
Интересный факт № 3
Карбамид (мочевина) является органическим соединением, так как образуется в живых организмах. Но сторонники витализма (учений, полагающих, что кроме как из животных организмов получить это вещество нельзя) были категорически настроены. Они утверждали, что производство мочевины искусственным путём невозможно. Однако благодаря опытам Берцелиуса и его учеников (Ф. Вёлер) мир узнал, что такой синтез вполне осуществим – из неорганических ком-понентов.
Благодаря своим свойствам, мочевина является веществом, агротехника и агро-химия – не единственные отрасли использования которого. Нефтяная промышлен-ность заинтересована в поставках карбамида, чтобы очищать масла и топлива от парафиновых соединений. Очищают мочевиной и трубы тепловых электростанций, и трубопроводы мусоросжигательных комбинатов, и отопительные котельные. Это делается для того, чтобы дым, формирующийся в системах, не содержал вредных для здоровья человека оксидов азота.
Интересный факт № 4
Такой разный карбимид
Трудно найти более «традиционное» для сельского хозяйства удобрение, чем мочевина. Классическая, гранулированная и приллированная формы карбамида много лет применяются для выращивания разных видов культур. Считалось, что это простое удобрение меньше всего требует модификаций.
Однако со временем карбамид начал претерпевать изменения и появляться в новых формах и с новым содержанием, например, в виде супергранул, которые являются самой крупной модификацией гранулометрического состава мочевины и были разработаны специально для сокращения потерь азота при выращивании риса.
Интересный факт № 5
Азот как макроэлемент является балансиром между ак-тивным ростом и наращиванием вегетативной массы. На первый взгляд можно вспомнить школьную химию и удивиться: как же так растениям может не хватать азо-та, если в воздухе содержание элемента составляет 78%?!
Но проблема в том, что молекулярную форму растения усваивать и преобразовывать не могут.
Поэтому помочь могут им либо клубеньковые азотфиксирующие бактерии-симбионты (например, они часто поселяются на корнях бобовых), либо растворимые в воде формы азота: мочевина или нитраты и нитриты. Но нитраты с избытком в со-бранном урожае мало кого устроят. Поэтому – карбамид!
Первые внешние признаки, говорящие о нехватке (избытке) азота в раститель-ном организме можно определить по таблице.
Интересный факт № 6
Это универсальное удобрение, которое подходит для любых агрокультур в любом фенологическом состоянии, любой фазе роста и развития. Сюда относятся растения закрытого и открытого грунта, плодовые деревья и ягодные кустарники, декоративные и цветущие культуры, зелёные декоративные насаждения (изгороди, газон) и кустарники, рассада.
Интересный факт № 7
Ещё одно неоспоримое достоинство мочевины в том, что её можно использовать на протяжении всего сезона, от ранней весны до поздней осени. Осеннее внесение в сухом виде с обязательной заделкой в почву на 4-5 см (например, при перекопке и подготовки огорода на зиму) обеспечивает устойчивость растениям к болезням, парше, вредителям. Весной с заделкой в почву – предотвращает недостаток азота в активной вегетационной поре и фазе роста. На протяжении летне-осеннего сезона возможны 1-2 профилактические подкормки в соответствии с необ-ходимой дозировкой тем или иным насаждениям. Рассада в период выращивания также отлично воспринимает жидкую подкормку азотсодержащим удобрением, так как набирает зелёную массу и активно фотосинтезирует.
Интересный факт № 8
Мочевина (карбамид) — это химическое соединение, которое имеет твёрдую структуру и представляет собой россыпь белых или слабоокрашенных кристаллов без запаха. Мочевина является конечным продуктом метаболизма белка у млекопитающих и некоторых рыб. Формула мочевины — NH2CONH2.
Интересный факт № 9
Мочевина получила такое название, поскольку её открытие имеет непосредственное отношение к моче. В 1773 году французский химик Илер Марен Руэль выделил её из жидкого продукта жизнедеятельности человека.
Впрочем, в 1828 году немецкий химик и врач Фридрих Вёлер получил подобное мочевине вещество путём упаривания растворённого в воде цианата-аммония (NH4 CNO). Именно с этого события начинается отсчёт истории органической химии, так как впервые было получено органическое соединение синтетическим путём. Как раз мочевина, полученная таким образом, и используется сегодня в самых разных от-раслях экономики.
Интересный факт № 10
После аммонификации азота карбамида происходит нитрификация. Для того, чтобы продлить стадию нитрификации в сельском хозяйстве применяют ингибиторы карбамида. При добавлении ингибитора нитрификации к удобрениям, содержащим мочевину, т. е. карбамид, фаза аммонийного азота в почве удлиняется.
Вследствие замедления образования нитратов из аммония растения получают обеспечение азотом в соответствии со своими потребностями. Помимо этого снижает-ся риск накопления нитратов в почве.
Стабилизированные ингибиторами нитрификации удобрения позволяют вносить более высокие дозы азота, не создавая рисков перехода излишков азота в нитраты.
И в завершении о Технике безопасности:
• все работы с карбамидом необходимо проводить с соблюдением мер индивидуальной защиты (специальные костюмы, ботинки или сапоги, перчатки, респиратор);
• при транспортировке карбамида следует исключать его неконтролируемое попадание в окружающую среду.
Также важно помнить!
🆘 Карбамид не рекомендуется смешивать с такими удобрениями, как простой суперфосфат, мел, доломит и известь. Это связано с тем, что они понижают кислотность мочевины при совместном внесении в почву.
🆘 Мочевину в больших дозах (например, в качестве припосевного удобрения) лучше вносить заблаговременно, т. к. в данном удобрении есть биурет, который в больших дозах может навредить растениям (период полного разложения биурета составляет две недели).
И все же карбамид – это органическое или неорганическое соединение?
Ответ за наукой! Но то, что полезное для агротехники – точно!