Про иммунитет, рак и аллергии, часть первая: провал терапии рака
Привет, Пикабу!
Так вышло, что по образованию я ученый-иммунолог, а работаю с онкологией, аутоиммунными заболеваниями и аллергией. Ученому хорошо бы уметь объяснять свои сложные штуки простым языком, поэтому сегодня начну, возможно, серию постов о том, в чем разбираюсь, и попробую популярно объяснить некоторые неочевидные темы.
Начнем с терапии рака, точнее того, почему многие препараты на клинических исследованиях проваливаются или показывают куда более слабые результаты в сравнении с ожиданиями. Прежде всего, если речь идет не о радио-/химиотерапии или условно индивидуальных методах лечения - вроде CAR-T терапии, - то речь почти всегда идет о таргетной терапии.
У онкологических заболеваний есть несколько общих фишек, способствующих их развитию. Часто это одни и те же общеизвестные молекулы. И вот таргетная терапия нацелена на выключение этих молекул с помощью других молекул, чаще всего антител.
Глобально таргетную терапию можно разделить на две группы: выключение веществ, нужных или для защиты от иммунитета, или для роста опухоли.
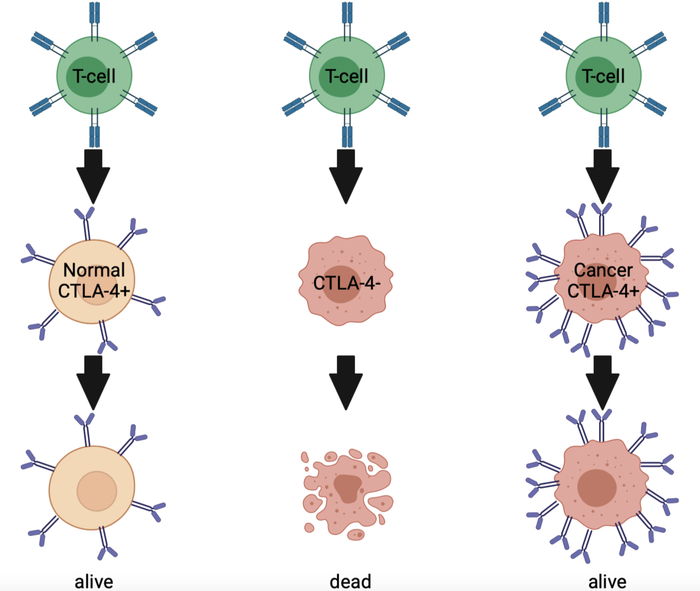
Самая известная молекула второго типа - CTLA4. Она есть на мембранах наших с вами здоровых клеток и нужна, чтобы защищать нас от атаки собственных Т-киллеров. Представьте себе это так: Т-киллеры - это ОМОН иммунитета, они бьют ссаными тряпками всех, кто предъявляет неправильные документы. А CTLA4 - это как раз правильная корка. И вот раковые клетки с неправильными документами вешают на себя так много этой молекулы, что Т-киллеры их не трогают, будто бы это нормальные клетки.
За разработку терапии, блокирующей CTLA4, в 2018 году выдали Нобелевскую премию по физиологии и медицине. Но на практике эффективность препарата чаще всего около 20%.
Одна из самых известных молекул в иммунологии - фактор некроза опухоли, TNF. Он и его ближайший гомолог лимфотоксин-альфа (LTa) заслуживают отдельного поста, но об этом позже. Сейчас нам важно, что и TNF, и лимфотоксин были замечены в помощи некоторым опухолям - к примеру, в присутствии TNF гораздо активнее растут рак кожи, груди, печени, да и не только.
Поэтому множество разработанных локаторов фактора некроза опухоли пытаются использовать в качестве терапии рака. Например, этанерцепт. Он, кстати, раз за разом проваливается в клинических испытаниях.
Почему это происходит?
Выяснилось, что это - результат научной парадигмы "публикуйся или умри" и желания сделать работу побыстрее. Путь от открытия до клин исследований выглядит чаще всего так:
1. Открытие;
2. Исследование функций;
3. Установление роли в онкологии;
4. Создание антител;
5. Тесты: на клеточных культурах, разных моделях животных;
6. Клинические испытания.
Проблема кроется в пятом этапе.
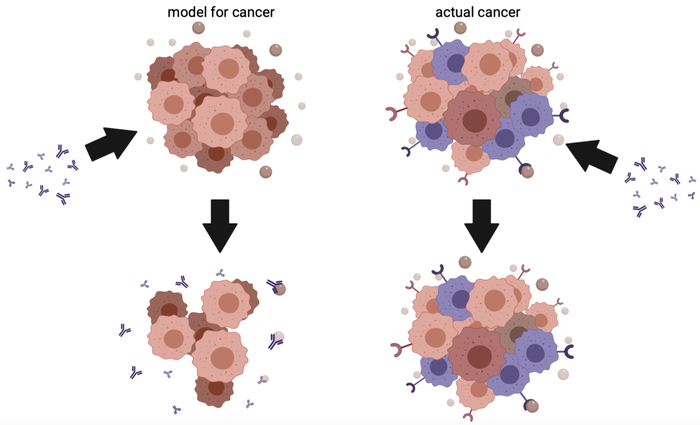
Тест на клеточных культурах, например - это взять чашку Петри, вырастить там клетки рака в среде цитокинов, получить типа опухоль, потом добавить туда блокатор и смотреть, как выращенный рак дохнет. Ура? Хрен там!
В реальности опухоль выглядит так, как на правой картинке: помимо собственно клеток рака (красные и розовые) в ней есть еще куча наших родных иммунных клеток, которые опухоль сама же и привлекает! В некоторых опухолях вообще до 80% - привлеченные клетки. Это называется опухолевым микроокружением, оно-то как раз способствует росту и метастазированию, защите от иммунитета.
И, как выяснилось год назад, причем на таких же выращенных в чашках культурах, просто с микроокружением - оно-то и препятствует работе этанерцепта, скажем. А почему этого не делали раньше? Потому что нужно чуть отойти от привычного протокола и подумать, с этим даже у людей науки не всегда хорошо.
Дальше - хуже.
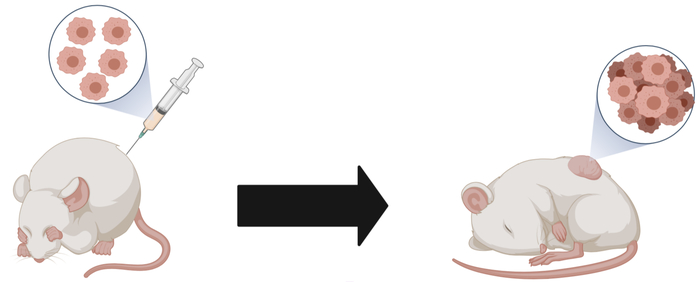
Никто не пустит ваш препарат в клиническое исследование, если вы не протестировали его работоспособность на животных. Поэтому берут мышей - и тестируют на них. И здесь есть сразу несколько проблем.
Первая - опять же, публикуйся или умри, поэтому в большинстве исследований выбирают самые быстрые модели: подсаживаемых опухолей. Для этого либо уже выросшая из культуры опухоль операционно подсаживается животному, либо культура закалывается в кровь животным. По итогу уже через месяц можно вырастить меланому, но она ни хрена не такая, как надо. Опять же, у таких методов проблема с формированием микроокружения. Это другая опухоль.
Вторая проблема - мыши в таких экспериментах иммунодефицитные, у них в принципе все лучше растет, а у препаратов более выраженный эффект.
Грубо говоря, если результаты такого исследования дают 80% эффективности препарата, результат клинических исследований будет в районе 20%.
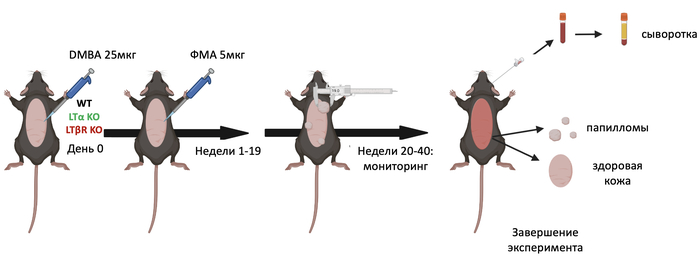
Так почему не делают на других моделях? Тут я просто приложу картинку из своей презентации по проекту:
Я работал с раком кожи, полный эксперимент у меня занимал 10 месяцев + 2 месяца дать мышам подрасти до рабочего возраста. Это очень долго и сложно. Чувствуете разницу между моделью на месяц и на почти год работы? Не каждый рак растет так долго, но модель, в которой рак развивается с нуля, а не подсаживается - это в любом случае минимум полгода работы.
Конечно, в идеале работать нужно с самыми точными моделями: здоровые мыши, индукция рака. Но заниматься этим никто не хочет. Процитирую своего бывшего коллегу:
- Вообще я хочу заняться раком, поизучать метаболизм... Но ни в коем случае не как ReligiousMadman! У него долго все в модели, я хочу чтоб ХОБА и через две недели результаты.
Вот поэтому, собственно, и имеем что имеем. На шестой этап - клинические тестирования - выходят совершенно не готовые к нему препараты, исследованные абы как. И это грустно.
На этом у меня пока что все, если рубрика зайдет, буду писать на регулярной основе.
Некоторые полезные ссылки:
1. Картинки делал здесь - biorender.com
2. Одна из статей (с открытым доступом) про CTLA4 и другую близкую штуку PD1: ncbi.nlm.nih.gov/pmc/articles/PMC5883082/
3. Статья об этанерцепте и микроокружении: bmccancer.biomedcentral.com/articles/10.1186/s12885-0...