Очень легкая химия (почти) ep 11
Сегодня речь пойдет о химической связи, её природе и теориях, описывающих её. Начать стоит с того, почему вообще возникает химическая связь. Как мы знаем, все в природе стремится к наименьшей энергии, многие атомы имеют на внешних энергетических уровнях неспаренные электроны, в таком состоянии они обладают большей энергией, так как более свободны (вырожденность электронов), следовательно образование связей в первую очередь связано с электронными эффектами и имеет электростатическую природу.
Так связи подразделяют на ионные, ковалентные и металлические, в действительности ни одна из этих связей не существует, все известные соединения имеют лишь некую долю ионности, ковалентности или металличности. Поэтому когда говорят, что связь в молекуле ковалентная, имеют ввиду её относительно высокую ковалентность. Теперь нужно разобраться с каждым видом связи по отдельности.
Ионная связь характеризуется большой разностью электроотрицательностей элементов, между которыми образуется связь, это означает, что электронная плотность между атомами сильно смещена в сторону более электроотрицательного и на нем возникает частично положительный заряд, на менее электроотрицательном атоме в свою очередь возникает частично положительный заряд и связь образуется за счет электростатических сил. Самой выраженной в природе ионной связью обладает фторид цезия, так как атомы цезия и фтора имеют самую большую разность электроотрицательностей. (По некоторым данным электроотрицательность гелия чуть выше чем у фтора, следовательно при прочих равных гелат цезия более «ионен» чем фторид).
Металлическая связь, как следует из названия присуща металлам, её особенностью является наличие свободных электронов в кристаллической решетке, что обеспечивает следующие физические свойства металлов: блеск, электропроводимость, ковкость, высокую теплопроводность, различные фотоэффекты.
Ковалентная связь образуется между атомами элементов, с небольшой разностью электроотрицательностей. Одним из способов описания ковалентной связи является метод валентных связей, суть которого заключается в образовании пар электронов. Либо каждый из атомов вкладывает в связь по одному электрону, либо один предоставляет пару, а другой свободную орбиталь, тогда связь называют донорно-акцепторной.
Эта теория является развитием теории октетов Льюиса, которая долгое время позволяла объяснять природу ковалентной связи, сейчас метод валентных связей чаще используют для качественного определения структуры соединения, так как на его основе построена модель Гиллеспи, определяющая пространственную структуру соединения как наиболее удаленное расположение электронов и электронных пар относительно друг друга. Так например сера в возбужденном состоянии имеет на внешнем энергетическом уровне шесть неспаренных электронов, следовательно они расположены в виде октаэдра, такой формой обладает гексафторид серы, азот в свою очередь имеет 3 электрона и одну НЭП (неподеленную электронную пару), следовательно их взаимное расположение будет соответствовать тетраэдру, в центре которого расположен атом азота. Поскольку мы не можем увидеть НЭП, соединения азота представляют из себя «зонтики» в вершине которых стоит атом азота.
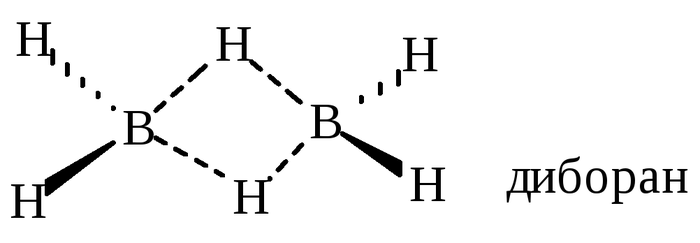
Кроме этого ковалентную связь можно описать с помощью метода молекулярных орбиталей, в его основе лежат представления об образовании молекулярных орбиталей, связывающих и разрыхляющих, они являются соответственно суммой и разностью волновых функций взаимодействующих электронов. Если проще, то молекулярные орбитали образуются за счет слияния орбиталей атомных, и структура полученной конструкции будет определяться как наиболее энергетически выгодное состояние системы. Данный метод более практически выгоден, так как позволяет исследовать сложные молекулы и ионы на наличие магнитных свойств, рассчитывать структуры сложных молекул, а также объяснить природу некоторых соединений, например электрондефицитного диборана.
Диборан является ближайшим гомологом гидрида бора и представляет большой интерес для ученых, так как связи в этой молекуле распределены не совсем очевидно.
Как видим на рисунке, водород с какой-то стати стал двухвалентным, хотя такого и в теории не может быть. Так и есть, здесь мы видим пример трехцентровой, двухэлектронной связи, где пара электронов локализована между тремя атомами.
Кроме внутри молекулярных связей существуют еще и связи межмолекулярные и делятся они на два основных типа: ван-дер-ваальсово взаимодействие и водородные связи.
Первое обозначает различные дипольные взаимодействия, начиная от обычного дипольного притяжения, заканчивая индуктивными эффектами, когда поляризация молекул происходит под действием внешних сил.
Водородные связи являются частным случаем донорно-акцепторных связей и образуются за счет свободной орбитали водорода, связанного с электроотрицательным атомом. Водородные связи существенно влияют на физические свойства веществ, если посмотрим на температуры кипения водородных соединений неметаллов 2 периода можем заметить, что температура кипения воды значительно отличается от аммиака и фтороводорода, это происходит из-за сильных водородных связей, возникающих между молекулами воды. Также не мало важен тот факт, что в молекуле воды у 2 атомов водорода есть 2 свободные орбитали, а у кислорода 2 пары электронов, такое соотношение и обеспечивает сильные межмолекулярные связи в воде.
Водородные связи важны и для живых организмов, благодаря ним образуется вторичная структура белка. В газовой фазе из-за водородных связей происходит димеризация некоторых молекул, водородные связи с растворителем улучшают растворимость некоторых веществ. Многие полимеры, в том числе и биологические образованы благодаря водородным связям.