Про pH, кислотность продуктов и необходимость ощелачивать организм простыми словами
Привет, я пищевой химик с дипломом инженера-технолога пищевой промышленности и степенью по биотехнологии. Для меня это очень важная тема, так как является предметом манипуляций с разводом граждан на приборы и добавки, в которых нет ни пользы, ни смысла. Так что буду экономить вам много тысяч рублей!
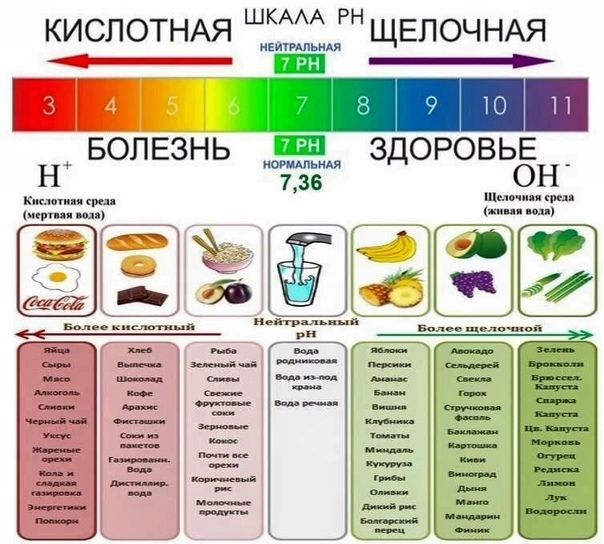
Наверняка выдели эту картинку или подобные ей. А может быть даже читали статьи по необходимости выщелачивания организма? Тогда разбираемся вместе, что такое pH и какие продукты действительно щелочные.
Я буду ориентироваться на тех, кто химию учил в 8-11 классах и почти ничего не помнит. Если ты, уважаемый читатель, продвинутый химик, вам может быть скучно. А еще прошу вас не придираться к упрощениям, если они в целом не противоречат научным представлениям. Если же где-то, на ваш взгляд, я погрешил истиной и вы знаете лучший способ изложить материал, не потеряв простоту изложения, пожалуйста, обратите мое внимание на это.
Я имел опыт преподавания в ВУЗе для ребят 20-ти лет и до сих пор, помимо основной работы технологом, преподаю на курсах повышения квалификации для коллег, в том числе гораздо более старшего возраста, и знаю, что даже для людей из отрасли, приходится порядочно упрощать специфические термины, если они не сталкиваются с ними в своей работе постоянно.
Итак, есть такие молекулы, которые умеют распадаться на два неравных фрагмента. Некоторые из них распадаются на части, одна из которых – заряженный водород (Н⁺) – такие вещества называются кислотами. Другие молекулы распадаются на части, одна из которых гидроксил (ОН⁻) – такие вещества называются щелочами. Когда Н⁺ встречается с ОН⁻ - получается вода (НОН или Н2О).
Кислоты и щелочи очень агрессивные соединения, которые могут растворять в себе разные другие вещества, в том числе и живые клетки, белки и прочее.
Кстати, ржавый налет на сантехнике лучше растворять в кислотах, а пригоревший жир – щелочью.
Прикол в том, что вода тоже распадается на фрагменты: на собственно Н⁺ и ОН⁻ - других у неё нет 😊. И всегда этих частей будет поровну. Когда в каком-нибудь растворе количество Н⁺ и ОН⁻ - одинаковое, среда называется нейтральной. Когда чего-то больше – кислой (больше Н⁺) или щелочной (больше ОН⁻). Но измерять и то и другое тоже накладно, ведь если в среде много Н⁺, значит там не может быть много ОН⁻, иначе они сольются в одном химическом экстазе и будет просто водичка. А потому решили, что достаточно измерять только количество Н⁺. А если нужно, то посчитать ОН⁻ всегда можно от обратного.
А что делать если одного компонента совсем много? Или много, но не значительно? А может и немного, но чуть больше, чем другого? В чем измерять эти концентрации? Ну, например в граммах на литр! Удобно же? Сколько грамм Н⁺ в литре раствора? Может быть 0,1 г/литр, а может быть 0,00000000000001 г/литр. Очень неудобно! Я пока писал два раза нули пересчитывал, чтобы не ошибиться!
Но тут пришли математики и сказали, что у них есть суперфункция – называется логарифм. Он позволяет сокращать все эти нули и приводить наши мега неудобные концентрации с большим количеством нолей после запятой к цифрам.
Так появился pH – отрицательный десятичный логарифм концентрации водорода, который превращает запись 0,1 г/литр в 1, а 0,00000000000001 г/литр в 14. Для обычных сред, особенно в пищевой химии – у нас тут ничего ядерного нет - не возможно встретить значения вне диапазона от 1 до 14. Вот и получилась характеристика кислотности или щелочности, которая по факту отражает сколько в среде ионов Н⁺. В воде концентрация ионов Н+ равна 0,00000001 г/литр отрицательный логарифм этой величины равен 7. Значение 7 – означает нейтральную среду.
Итак, вывод первый: на картинке не соврали, что значения pH менее 7 означают кислую среду, выше 7 щелочную. А вот с остальным всё печально.