Как работает иммунная система, лекция 8 ч. 4 (ч. 79)
ТЕСТИРОВАНИЕ ТИМУСА НА АУТОТОЛЕРАНТНОСТЬ
Во время или после положительного отбора в коре тимуса Т-клетки перестают демонстрировать либо одну, либо другую из молекул корецепторов, CD4 или CD8. Эти клетки называются одиночно-положительными (SP) клетками. Точный механизм, с помощью которого Т-клетка “выбирает” между отображением корецепторов CD4 или CD8, все еще изучается. Однако выбор корецептора зависит от того, распознает ли конкретная Т-клетка свой родственный антиген, отображаемый молекулами ГКГ класса I или II на эпителиальной клетке коры тимуса. Например, если рецепторы Т-клеток распознают антиген, отображаемый молекулами ГКГ класса I, корецепторы CD8 на поверхности Т-клеток “присоединятся к группе” и закрепятся на молекуле ГКГ. Когда это происходит, экспрессия молекул CD4 на этой Т-клетке снижается. И аналогично, Т-клетка, рецепторы которой распознают пептид, выделяемый молекулами класса II, станет Т-клеткой CD4, и экспрессия корецепторов CD8 на этой клетке будет отключена. Эта стратегия работает, потому что корецепторы CD8 связываются только с молекулами ГКГ класса I, а корецепторы CD4 связываются только с молекулами ГКГ класса II.
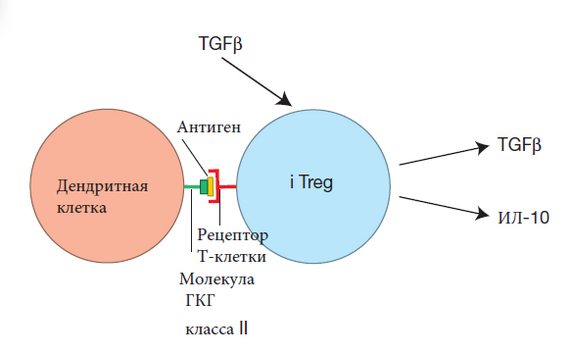
Те Т-клетки, чьи рецепторы распознают собственный ГКГ и пептид, начинают экспрессировать хемокиновый рецептор CCR7 на своей поверхности и направляются из коры в центральную область тимуса, называемую медуллой, где много лигандов для CCR7. Именно в медулле тимуса проводится второй тест — тест на аутотолерантность. Этот тест часто называют негативным отбором.
Вопрос к Т-клеткам во время негативного отбора, звучит так: узнаете ли вы какие-либо из собственных пептидов, отображаемых молекулами ГКГ на моей поверхности?
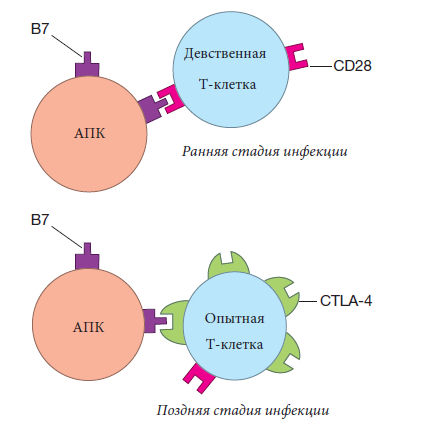
Правильный ответ: “Ни за что!”, — потому что Т-клетки с рецепторами, которые распознают комбинацию молекул ГКГ и собственных пептидов, удаляются. Если аутореактивные Т-клетки не удалены, начинается аутоиммунное заболевание. Например, T–помощники, распознающие собственные антигены, могли бы помочь В-клеткам вырабатывать антитела, которые помечали бы наши собственные молекулы (например, белки инсулина в нашей крови) для уничтожения или могли бы вырабатываться ЦТЛ, которые атаковали бы наши собственные клетки.
Перевод книги LAUREN SOMPAYRAC "HOW THE IMMUNE SYSTEM WORKS", продолжение следует.