Табакокурение и старение кожи ч.2
Рак кожи
В ходе эпидемиологических исследований выявлены как положительные, так и отрицательные взаимосвязи между курением, заболеваемостью и агрессивностью определенных типов рака кожи. Развитие индуцированного курением рака кожи объясняют следующими механизмами: ускоренное старение, мутагенез, стимуляция роста и инвазии опухолевых клеток, неоваскуляризация и ремоделирование стромы.
Несмотря на то, что есть исследования, в которых не обнаружили никакой взаимосвязи с курением, [25] большинство работ установили, что курение — независимый фактор риска развития плоскоклеточного рака (ПР), в частности, ПР пениса, вульвы, шейки матки и ануса [26]. Прекращение табакокурения приводит к снижению этих рисков [27]. Курение увеличивает заболеваемость высокоагрессивными формами ПР вульвы и снижает выживаемость.
Курящие женщины с генитальными бородавками в 35 раз сильнее подвержены развитию рака вульвы, что предполагает наличие синергии между курением и генитальными бородавками [27]. Также установлена достоверная взаимосвязь злокачественных новообразований ротовой полости с курением [28]. Курение сигарет без фильтра еще больше увеличивает риск [29]. Курящие женщины особенно подвержены ПР ротовой полости [30].
Большинство исследований не нашли четкой ассоциации между курением и риском базально-клеточного рака (БКР) [26], но данные противоречивы. Курение сигарет, возможно, связано с преобладанием больших по размеру БКР (>1 см в диаметре) [31] и более агрессивных форм [32].
Более ранние исследования, в которых изучалась взаимосвязь курения и меланомы, выявили, что количество курящих мужчин в ремиссии через пять лет после постановки диагноза значительно меньше, чем некурящих [33]. У курильщиков выше вероятность раннего и висцерального метастазирования [34]. Более поздние исследования, однако, показывают, что привычка курить никак не влияет на риск злокачественного течения меланомы [26].
Многолетнее курение даже может снизить риск развития меланомы, особенно акральной меланомы [35]. Защитный эффект курения относительно кожной меланомы может быть связан с участием никотина в синтезе меланина, его аффинитетом к меланин-содержащим тканям, необратимым связыванием с меланином и депонированием канцерогенов табака NNK и NNN в тканях, содержащих меланин. Примечательно, что на примере бесшерстных мышей было показано ингибирующее влияние компонентов табака, обусловленное блоком сигнального пути ядерного фактора-jB, на индуцируемые облучением UVB опухоли кожи [13].
Курение связано со сниженным риском классической саркомы Капоши (кСК) [36] и СПИД-ассоциированной саркомой Капоши. Однако в ходе клинических испытаний трансдермальный никотин в лечении кСК у некурящих оказался неэффективным относительно очагов кСК или вирусной нагрузки HHV-8 [38]. Канцерогенность табака в основном связана с действием ПАУ, нитрозаминов и гетероциклических аминов.
Известно, что курение замедляет репарацию одноцепочечных разрывов ДНК [39], а также оказывает прямой онкогенный эффект [40]. Проонкогенный эффект никотина также объясняется увеличением частоты митозов клеток базального слоя и появлением гипертрофированных эпителиальных клеток в эпидермисе [41]. Никотин и нитрозамин, содержащиеся в табаке, способствуют росту опухолей благодаря положительной регуляции клеточных нХР, что индуцирует инвазию злокачественных клеток и ингибирует апоптоз [42]. Проинвазивные эффекты никотина обусловлены нХР-α7 [43]. Никотин увеличивает секрецию ацетилхолина, а также экспрессию и активность нХР в злокачественных клетках [44].
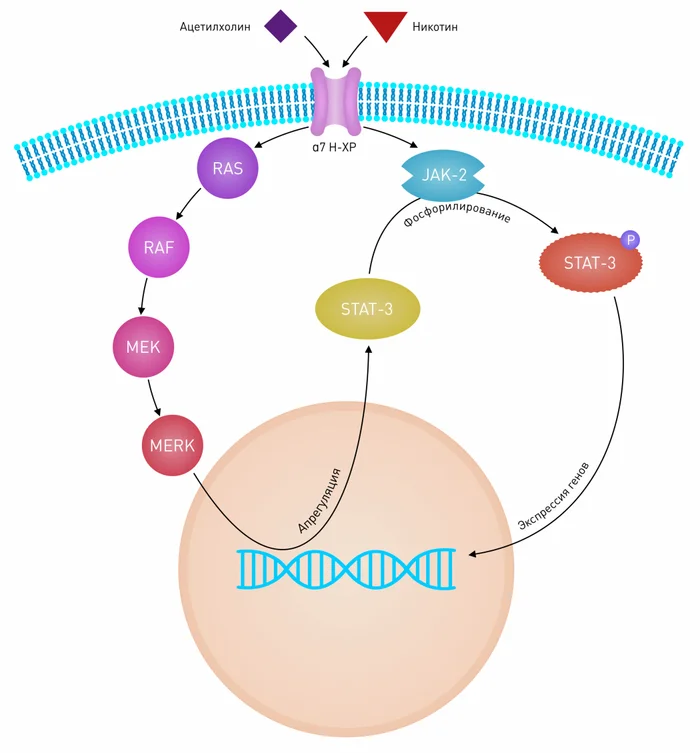
Рецептор‑опосредованная токсичность табака — результат взаимодействия нисходящих сигнальных путей Ras/Raf‑1/MEK1/ERK, а также JAK-2/STAT-3, начинающихся с активации нХР‑α7 кератиноцитов (Рис. 5) [45]. Также доказано, что никотин стимулирует рост опухолей за счет увеличения активности phospho-ERK (фосфорилированная киназа, регулируемая внеклеточными сигналами). Пролиферативные эффекты никотина можно предотвратить при помощи высокоаффинного блокатора нХР‑α7 — α‑кобратоксина [46]. Фармакологический блок нХР-α7 растормаживает апоптоз и снижает экспрессию фактора роста эндотелия сосудов (VEGF) — это приводит к ингибированию ангиогенеза [47].
Рисунок 5 |Взаимодействие нисходящих сигнальных путей Ras/Raf/MEK/ERK и JAK-2/STAT-3 с нХР-α7 кератиноцитов
Стимуляция нХР-α7 как физиологическим лигандом — ацетилхолином, так и никотином ведет к изменению в экспрессии гена посредством трансактивации STAT-3. Трансактивация может происходить через два сигнальных пути, сопряженных с нХР-α7. Путь последовательной активации Ras/Raf/MEK/ERK приводит к увеличению концентрации STAT-3 в цитоплазме, благодаря положительной регуляции экспрессии, тогда как активация тирозин киназы JAK-2 обусловливает фосфорилирование STAT-3 с последующей транслокацией димеров STAT-3 в ядро, где и произойдет изменение экспрессии гена.
Известны также и непрямые онкогенные эффекты никотина, связанные с эндотелиальными клетками и фибробластами дермы. Никотин может усилить рост опухоли за счет усиления опухолевой васкуляризации и создания про‑канцерогенной среды в строме [49]. Воздействие экстракта бездымного табака на дермальные фибробласты усиливает выработку факторов, ускоряющих пролиферацию и прорастание иммортализированных кератиноцитов. Таким образом, ультрафиолет и нитрозамины табака могут индуцировать канцерогенез, тогда как никотин способствует росту и распространению измененных клеток.
Нарушение заживления ран
У курильщиков повышен риск осложнений операционных ран [50]. Исследования на животных показали, что курение в течение восьми недель до хирургической операции увеличивает вероятность некроза кожного лоскута [51]. В то же время, воздержание от курения снижает вероятность инфекционных осложнений [52].
Патобиологические основы изменения заживления ран под действием табака сходны с таковыми при преждевременном старении кожи. Например, также снижается выработка коллагена и изменяется метаболизм межклеточного вещества с увеличением уровней MMP-8. Показано, что это способствует нарушению процессов регенерации.
Вероятно, курение также влияет на заживление ран за счет ингибирования миграции фибробластов к раневому ложу, что ведет к их накоплению по краю раны. Увеличение продолжительности жизни фибробластов одновременно со снижением их миграции может способствовать фиброзированию и чрезмерному рубцеванию [54]. Важно, что эпителизация раны обусловливается миграцией кератиноцитов поверх обнаженной дермы. Миграция кератиноцитов регулируется как никотиновыми, так и мускариновыми подтипами ХР. Ее можно ингибировать при помощи активации нХР-α7, которые ответственны за сопряжение ионных потоков с каскадами протеинкиназных сигнальных путей, регулирующих экспрессию интегрина и активность Rho-киназы [55–58].
Курение может замедлять заживление ран опосредованно через замедление кровотока. В то время, как курение снижает объемный кровоток, концентрацию кислорода и активность аэробного метаболизма в коже, никотин сам по себе увеличивает содержание кислорода в тканях, даже несмотря на сниженный кровоток [59].
Скорее всего, влияние курения на микроциркуляцию обусловлено не воздействием никотина. Вероятно, никотин оказывает влияние на регенерацию только в токсических дозах. В терапевтическом диапазоне, однако, трансдермальный никотин показал себя с другой стороны: он нормализует микрососудистую перфузию кожи пальцев [60] и стимулирует заживление ран и ангиогенез [61]. В эксперименте на мышах никотин значимо способствовал регенерации [62]. Помимо положительной регуляции темпа эпителизации, механизм, вероятно, связан с усиленным синтезом коллагена типа I [63].
Хронические дерматозы, на которые влияет курение
Контактный дерматит
Курение сигарет и употребление нюхательного табака — доказанные факторы риска развития аллергического контактного дерматита. В сигаретах обнаруживают следующие аллергены: какао, ментол, лакрица, канифоль и формальдегид [64]. Курение дозозависимо повышает вероятность положительной накожной пробы на никель [65]. Никотин, сам выступая аллергеном, в кожных пробах может вызывать аллергический или простой контактный дерматит на месте аппликации [66].
Атопический дерматит
Хотя у курящих людей титр IgE в сыворотке значительно выше, чем у некурящих, сведения относительно влияния курения на атопический дерматит противоречивы. В одних исследованиях докладывают, что курение — независимый фактор риска экземы кистей [68]. Однако другие исследования такой взаимосвязи между курением и атопическим дерматитом или экземой кистей не выявили [69].
Псориаз
Хороша известна значительная прямая корреляция между псориазом и курением, зависящая от количества сигарет, выкуриваемых в день [69]. Курение — независимый фактор риска псориаза [70], более опасный у мужчин [71]. Более того, периоды ремиссии после лечения у курильщиков короче [72].
Ладонно-подошвенный пустулез (ЛПП)
ЛПП (Рис. 6) — одно из наиболее распространенных воспалительных заболеваний кожи, связанное с курением. Около 95 % всех больных ЛПП — курильщики, большинство — заядлые [73]. Прекращение табакокурения значительно улучшает состояние: меньше пустул, меньше площадь эритемы с шелушением [74]. Мишень воспаления при ЛПП — акросирингиум (Интраэпидермальная часть протока потовой железы — прим. ред.). Из-за нарушенной экспрессии нХР и других компонентов холинергической системы кожи у пациентов с ЛПП может развиваться аномальная воспалительная реакция на никотин. Эти наблюдения указывают на роль никотина в патогенезе ЛПП [75].
Кожная красная волчанка
Исследования выявили статистически значимую связь между активным курением и развитием кожной красной волчанки [76]. Также была показана связь дискоидной красной волчанки (ДКВ) и курения. У курильщиков с ДКВ более обширные поражения при дебюте заболевания [77]. Также эффективность терапии антималярийными препаратами снижается при курении [78].
Болезни волос и волосяных фолликулов
Курение связано с преждевременным поседением волос как у мужчин, так и у женщин, а также с более ранней потерей волос у мужчин [79]. Течение андрогенетической алопеции при частом курении усугубляется, а дебют происходит тем раньше, чем выше доза [80]. Исследования in vivo показали, что у мышей, подвергшихся воздействию табака, развивается атрофия эпидермиса, истончается подкожная жировая клетчатка, количество волосяных фолликулов уменьшается. Также в луковице волоса наблюдается клеточный апоптоз [81]. Курение влияет на микроциркуляторное русло волосяного сосочка в дерме и приводит к повреждению ДНК клеток волосяного фолликула [82].
Оно также выводит из равновесия систему протеаз-антипротеаз, что ведет к изменениям в цикле роста волос. Увеличение концентрации провоспалительных цитокинов вызывает микровоспаление и фиброз фолликулов.
Пустулезные дерматозы
В то время, как одни исследования говорят о дозозависимой линейной связи заболеваемости и тяжести вульгарного акне с табакокурением [83], другие работы такой взаимосвязи не выявили [84]. Напротив, докладывают о более низкой распространенности акне среди курильщиков [85]. Риск развития розацеа среди курильщиков также ниже, вероятно, вследствие сосудосуживающего действия курения [86]. Установлена четкая взаимосвязь курения с гнойным гидраденитом (т. н. инверсные угри) [87]. Ключевым звеном патогенеза гнойного гидраденита, вероятно, выступают холиночувствительные клетки не‑нервного происхождения, о чем говорит аномальная экспрессия нХР в вовлеченной в процесс коже [88].
Пузырные дерматозы
В литературе отмечают, что при курении вульгарная пузырчатка протекает благоприятнее. Это согласуется с данными о том, что среди больных пемфигусом курильщики составляют меньшую часть [89]. Курильщики с вульгарным пемфигусом выходят в частичную и полную ремиссию чаще некурящих [90]. Также существует обратная связь табакокурения с герпетиформным дерматитом и с ассоциированной целиакией [91]. У курильщиков с недавно выявленной целиакией реже обнаруживают антитела к эндомизию, чем у некурящих [92]. Однако в одном исследовании не обнаружили какой-либо взаимосвязи курения с наличием антиглиадиновых антител [93]. Значимой взаимосвязи между курением и пемфигоидом слизистых оболочек не обнаружили [94].
Язвы кожи
Курение — фактор риска развития пролежней [95] и инфицированных язв у пациентов с диабетом [96]. Более 90 % пациентов с язвенными поражениями вследствие болезни Бюргера (облитерирующий тромбангиит) — курильщики. Длительные ремиссии возможны при прекращении табакокурения, тогда как рецидивы обусловлены возвращением ко вредной привычке [97].
Вирусные заболевания кожи
Известно, что курение увеличивает риск возникновения генитальных бородавок у мужчин [98]. А вот заболеваемость рецидивирующим герпесом губ у курильщиков, напротив, значительно ниже, особенно при курении трубки [99]. Скорее всего это связано со способностью табака ингибировать репликацию вируса простого герпеса и значительно снижать его цитолитический эффект [100]. Однако более свежие исследования показали, что аппликации никотина через трансдермальный пластырь индуцируют реактивацию вируса простого герпеса, а также вирусовыделение у кроликов-носителей инфекции [101].
Другие заболевания кожи и слизистых оболочек
Значимая связь установлена между курением и диабетическим липоидным некробиозом [102]. Курение также связывают с генерализованной крапивницей [103]. У мужчин, курящих сигареты или биди, риск развития повреждений кожи, связанных с действием мышьяка, значительно выше, чем у некурящих [104]. С другой стороны, существует обратная связь табакокурения с географическим языком [105].
Заболевания кожи, в лечении которых используют никотин
Как уже было отмечено выше, курение может усугублять течение некоторых заболеваний, способствовать канцерогенезу и потенциально ведет к зависимости. Однако, как бы это ни было парадоксально, в случае многих дерматологических заболеваний никотин показывает себя эффективным средством монотерапии. Болезнь Бюргера четко ассоциирована с курением, но ее успешно лечат при помощи жевательной резинки, содержащей никотин (Рис. 7) [106]. Вероятно, другие компоненты табака индуцируют спазм сосудов и утяжеляют течение облитерирующего тромбангиита, однако использование никотина может обладать ценным терапевтическим потенциалом. Помимо этого, ключевым компонентом лечения болезни Бюргера является отказ от курения.
(а)Левый большой палец ноги с большой глубокой язвой (1,5–2,0 см) у 38-летнего мужчины, который курит 20 лет.
(b) Язва зажила через 20 дней после начала лечения никотиновой жевательной резинкой (2 мг на штуку), назначенной по два раза в день. По крайней мере 14 месяцев спустя на фоне приема 2 никотиновых жвачек в день без других препаратов ноги пациента оставались в хорошем состоянии: без язв или перемежающейся хромоты.
Также известно о терапевтическом эффекте курения сигарет на афтозные язвы слизистой оболочки ротовой полости и гениталий при болезни Бехчета [107]. Соответствующим образом, прекращение курения ведет к появлению кожно-слизистых проявлений, особенно афтозного стоматита. Однако при лечении никотином афтозные язвы регрессируют в течение нескольких дней [108]. Механизм такого действия, вероятно, связан со способностью никотина ингибировать высвобождение провоспалительных цитокинов IL-6 и IL-8 из кератиноцитов и эндотелиальных клеток в дерме. Экстракт табачного дыма также снижает выброс IL-8, но увеличивает выработку VEGF кератиноцитами человека [109].
Воспалительные заболевания кишечника (ВЗК), по данным эпидемиологов, связаны с курением [110]. Курение и/или употребление чистого никотина может влиять на такие проявления ВЗК на слизистых оболочках и коже, как афтозный стоматит, гангренозная пиодермия и узловатая эритема. Большинство пациентов с неспецифическим язвенным колитом — некурящие либо прекратившие курение [111]. Прекращение курения усугубляет прогрессирование неспецифического язвенного колита (НЯК), но прогрессия замедляется вновь при возобновлении курения. Напротив, курящие пациенты с болезнью Крона склонны к более тяжелому течению [112]. Никотин — ключевой компонент табака, оказывающий влияние на ВЗК, ведь известно, что его введение через трансдермальные пластыри ингибирует воспаление при НЯК, чего не наблюдается при болезни Крона [113].
Интересно, что у мышей с колитом, индуцированным тринитробензол-сульфоновой кислотой, получавших анабазин — агонист нХР-α7, — повреждения тканей были менее выраженными, чем у мышей, не получавших его [114]. Никотин также применяли при лечении гангренозной пиодермии и узловатой эритемы, вероятно, ассоциированных с ВЗК, и при лечении злокачественного атрофического папулеза (т. н. болезнь Дегоса) [117], болезни Кимуры [116] и эозинофильного пустулезного фолликулита [118].
Подобно неспецифическому язвенному колиту, рецидивирующий афтозный стоматит (РАС) реже встречается у курильщиков [119]. Известно, что афтозный стоматит при резком прекращении курения также внезапно обостряется, а при возобновлении ослабевает. Заместительная терапия никотином значительно снижает частоту рецидивов РАС — вероятно, никотин можно использовать как лекарственное средство [120]. Хотя опубликованные исследования не говорят о взаимосвязи курения с красным плоским лишаем (КПЛ) слизистой оболочки ротовой полости, известен один случай КПЛ, резистентного к другим методам, который ответил на никотиновую жвачку [121].
Показано, что трансдермальный никотин напрямую снижает воспаление в коже [122]. Никотин и другие агонисты нХР могут оказывать противовоспалительное действие за счет ингибирования пролиферации лимфоцитов, эндоцитоза и фагоцитоза дендритными клетками, а также выработки АФК, супероксида и провоспалительных цитокинов [123].
Вероятно, механизм противовоспалительного действия также обусловлен противовоспалительными цитокинами, IL-10 и TGF-b, глюкокортикоидами и растворимыми рецепторами, нейтрализующими эффекты провоспалительных цитокинов. Никотин стимулирует нХР-α7, которые модулируют воспаление в отсутствие парасимпатической иннервации. Это незаменимый рецептор, необходимый для ингибирования синтеза цитокинов в ходе реализации холинергических противовоспалительных путей [124]. Наоборот, отсутствие нХР-α7 приводит к усилению провоспалительного цитокинового ответа [125].
Заключение
Табак и его компоненты влияют на кожу напрямую и опосредованно. Различные клетки кожи экспрессируют подтипы нХР, активность которых влияет на жизнеспособность клеток и их функции. Изменения в коже обусловлены как геномными, так и негеномными эффектами токсинов табака и агонистов нХР. Эффекты разнообразны: от ускорения процессов старения до мутагенеза.
Эпидемиологические исследования установили как положительную, так и отрицательную взаимосвязь табакокурения с различными заболеваниями кожи. Положительная связь с определенными болезнями может благоприятно сказываться на их течении при прекращении курения, тогда как обратная — может требовать специфического лечения агонистами никотина. Важно понимать отличие действия табака и чистого никотина при болезни Бюргера.
Частично противовоспалительный эффект никотина обусловлен стимуляцией нХР-α7. Эффекты компонентов табака и чистого никотина приведены в Таблице 1. Необходимы дальнейшие исследования никотинергических веществ в качестве потенциальных терапевтических агентов для некоторых кожных заболеваний.
Таблица 1 | Обобщенные эффекты табака/никотина на кожу
Перевод: Антон Желонкин
Редакция: Алиса Скнар, Телли Мурадова, Михаил Гусев
Оформление: Cornu Ammonis
Источники:
1 Benowitz NL, Jacob P III. Metabolism of nicotine to cotinine studied by a dual stable isotope method. Clin Pharmacol Ther 1994; 56: 483–493.
2 Kintz P, Henrich A, Cirimele V, Ludes B. Nicotine monitoring in sweat with a sweat patch. J Chromatogr B Biomed Sci Appl 1998; 705: 357–361.
3 Izzotti A, Cartiglia C, Longobardi M, et al. Alterations of gene expression in skin and lung of mice exposed to light and cigarette smoke. FASEB J 2004; 18: 1559–1561.
4 Grando SA, Pittelkow MR, Schallreuter KU. Adrenergic and cholinergic control in the biology of epidermis: physiological and clinical significance. J Invest Dermatol 2006; 126 : 1948–1965.
5 Axell T, Hedin CA. Epidemiologic study of excessive oral melanin pigmentation with special reference to the influence of tobacco habits. Scand J Dent Res 1982; 90: 434–442.
6 Hanioka T, Tanaka K, Ojim a M, Yuuki K. Association of melanin pigmentation in the gingiva of children with parents who smoke. Pediatrics 2005; 116: e186–e190.
7 Wallstrom M, Sand L, Nilsson F, Hirsch JM. The long- term effect of nicotine on the oral mucosa. Addiction 1999; 94: 417–423.
8 Claffey DJ, Stout PR, Ruth JA. 3H-nicotine, 3H- flunitrazepam, and 3H-cocaine incorporation into melanin: a model for the examination of drug-melanin interactions. J Anal Toxicol 2001; 25: 607–611.
9 Domellof L, Andersson M, Tjalve H, et al. Distribution and metabolism of N’-nitrosonornicotine in the miniature pig. Carcinogenesis 1987; 8: 1741–1747.
10 Model D. Smoker’s face: an underrated clinical sign? Br Med J (Clin Res Ed) 1985; 291: 1760–1762.
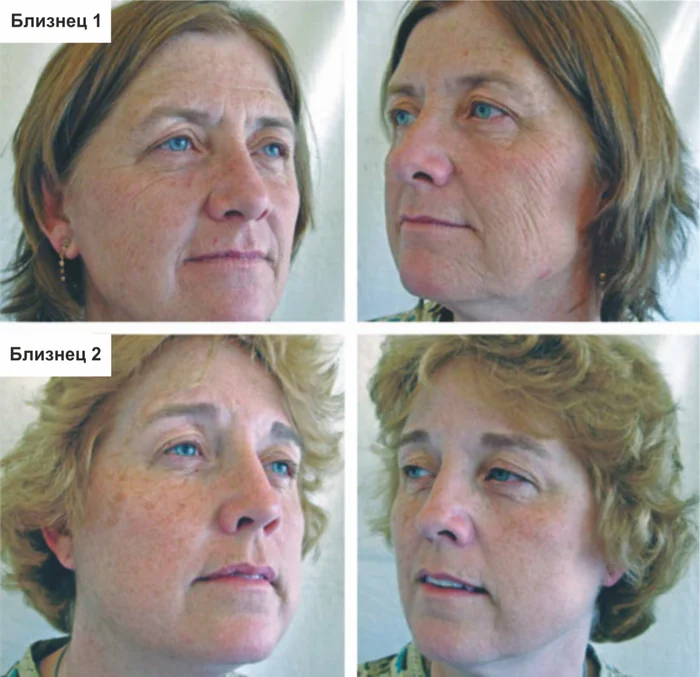
11 Doshi DN, Hanneman KK, Cooper KD. Smoking and skin aging in identical twins. Arch Dermatol 2007; 143: 1543–1546.
12 Pavlou P, Rallis M, Deliconstantinos G, et al. In-vivo data on the influence of tobacco smoke and UV light on murine skin. Toxicol Ind Health 2009; 25: 231– 239.
13 Gottipati KR, Poulsen H, Starcher B. Passive cigarette smoke exposure inhibits ultraviolet light B-induced skin tumors in SKH-1 hairless mice by blocking the nuclear factor kappa B signalling pathway. Exp Dermatol 2008; 17: 780–787.
14 Chung JH, Lee SH, Youn CS, et al. Cutaneous photodamage in Koreans: influence of sex, sun exposure, smoking, and skin color. Arch Dermatol 2001; 137: 1043–1051.
15 Helfrich YR, Yu L, Ofori A, et al. Effect of smoking on aging of photoprotected skin: evidence gathered using a new photonumeric scale. Arch Dermatol 2007; 143: 397–402.
16 Nicita-Mauro V, Lo Balbo C, Mento A, et al. Smoking, aging and the centenarians. Exp Gerontol 2008; 43: 95– 101.
17 Knuutinen A, Kokkonen N, Risteli J, et al. Smoking affects collagen synthesis and extracellular matrix turnover in human skin. Br J Dermatol 2002; 146: 588–594.
18 Yin L, Morita A, Tsuji T. Alterations of extracellular matrix induced by tobacco smoke extract. Arch Dermatol Res 2000; 292: 188–194.
19 Morita A. Tobacco smoke causes premature skin aging. J Dermatol Sci 2007; 48: 169–175.
20 Just M, Ribera M, Monso E, et al. Effect of smoking on skin elastic fibres: morphometric and immunohistochemical analysis. Br J Dermatol 2007; 156: 85–91.
21 Lahmann C, Bergemann J, Harrison G, Young AR. Matrix metalloproteinase-1 and skin ageing in smokers. Lancet 2001; 357: 935–936.
22 Yin L, Morita A, Tsuji T. Tobacco smoke extract induces age-related changes due to modulation of TGF-beta. Exp Dermatol 2003; 12(Suppl. 2): 51–56.
23 Arredondo J, Nguyen VT, Chernyavsky AI, et al. Functional role of a7 nicotinic receptor in physiological control of cutaneous homeostasis. Life Sci 2003; 72: 2063–2067.
24 Arredondo J, Hall LL, Ndoye A, et al. Central role of fibroblast alpha3 nicotinic acetylcholine receptor in mediating cutaneous effects of nicotine. Lab Invest 2003; 83: 207–225.
25 Odenbro A, Bellocco R, Boffetta P, et al. Tobacco smoking, snuff dipping and the risk of cutaneous squamous cell carcinoma: a nationwide cohort study in Sweden. Br J Cancer 2005; 92: 1326–1328.
26 De Hertog SA, Wensveen CA, Bastiaens MT, et al. Relation between smoking and skin cancer. J Clin Oncol 2001; 19: 231–238.
27 Moore TO, Moore AY, Carrasco D, et al. Human papillomavirus, smoking, and cancer. J Cutan Med Surg 2001; 5: 323–328.
28 Takezaki T, Hirose K, Inoue M, et al. Tobacco, alcohol and dietary factors associated with the risk of oral cancer among Japanese. Jpn J Cancer Res 1996; 87: 555–562.
29 Kabat GC, Chang CJ, Wynder EL. The role of tobacco, alcohol use, and body mass index in oral and pharyngeal cancer. Int J Epidemiol 1994; 23: 1137–1144.
30 Muscat JE, Richie JP Jr, Thompson S, Wynder EL. Gender differences in smoking and risk for oral cancer. Cancer Res 1996; 56: 5192–5197.
31 Smith JB, Randle HW. Giant basal cell carcinoma and cigarette smoking. Cutis 2001; 67 : 73–76.
32 Erbagci Z, Erkilic S. Can smoking and/or occupational UV exposure have any role in the development of the morpheaform basal cell carcinoma? A critical role for peritumoral mast cells Int J Dermatol 2002; 41: 275–278.
33 Shaw HM, Milton GW, McCarthy WH, et al. Effect of smoking on the recurrence of malignant melanoma. Med J Aust 1979; 1: 208–209.
34 Smith JB, Fenske NA. Cutaneous manifestations and consequences of smoking. J Am Acad Dermatol 1996; 34: 717–732; quiz 733–734.
35 Green A, McCredie M, MacKie R, et al. A case-control study of melanomas of the soles and palms (Australia and Scotland). Cancer Causes Control 1999; 10: 21–25.
36 Anderson LA, Lauria C, Romano N, et al. Risk factors for classical Kaposi sarcoma in a population-based case- control study in Sicily. Cancer Epidemiol Biomarkers Prev 2008; 17: 3435–3443.
37 Nawar E, Mbulaiteye SM, Gallant JE, et al. Risk factors for Kaposi’s sarcoma among HHV-8 seropositive homosexual men with AIDS. Int J Cancer 2005; 115: 296–300.
38 Goedert JJ, Scoppio BM, Pfeiffer R, et al. Treatment of classic Kaposi sarcoma with a nicotine dermal patch: a phase II clinical trial. J Eur Acad Dermatol Venereol 2008; 22 : 1101–1109.
39 Sauvaigo S, Bonnet-Duquennoy M, Odin F, et al. DNA repair capacities of cutaneous fibroblasts: effect of sun exposure, age and smoking on response to an acute oxidative stress. Br J Dermatol 2007; 157: 26–32.
40 Curtin GM, Hanausek M, Walaszek Z, et al. Short-term biomarkers of cigarette smoke condensate tumor promoting potential in mouse skin. Toxicol Sci 2006; 89: 66–74.
41 Inaloz HS, Inaloz SS, Deveci E, Eralp A. Teratogenic effects of nicotine on rat skin. Clin Exp Obstet Gynecol 2000; 27: 241–243.
42 Davis R, Rizwani W, Banerjee S, et al. Nicotine promotes tumor growth and metastasis in mouse models of lung cancer. PLoS ONE 2009; 4: e7524.
43 Dasgupta P, Rizwani W, Pillai S, et al. Nicotine induces cell proliferation, invasion and epithelial-mesenchymal transition in a variety of human cancer cell lines. Int J Cancer 2009; 124: 36–45.
44 Song P, Spindel ER. Basic and clinical aspects of non- neuronal acetylcholine: expression of non-neuronal acetylcholine in lung cancer provides a new target for cancer therapy. J Pharmacol Sci 2008; 106: 180–185.
45 Arredondo J, Chernyavsky AI, Jolkovsky DL, et al. Receptor-mediated tobacco toxicity: cooperation of the Ras/Raf-1/MEK1/ERK and JAK-2/STAT-3 pathways downstream of alpha7 nicotinic receptor in oral keratinocytes. FASEB J 2006; 20: 2093–2101.
46 Paleari L, Catassi A, Ciarlo M, et al. Role of alpha7- nicotinic acetylcholine receptor in human non-small cell lung cancer proliferation. Cell Prolif 2008; 41: 936– 959.
47 Paleari L, Sessa F, Catassi A, et al. Inhibition of non- neuronal alpha7-nicotinic receptor reduces tumorigenicity in A549 NSCLC xenografts. Int J Cancer 2009; 125: 199–211.
48 Heeschen C, Jang JJ, Weis M, et al. Nicotine stimulates angiogenesis and promotes tumor growth and atherosclerosis. Nat Med 2001; 7: 833–839.
49 Coppe JP, Boysen M, Sun CH, et al. A role for fibroblasts in mediating the effects of tobacco-induced epithelial cell growth and invasion. Mol Cancer Res 2008; 6: 1085–1098.
50 Rogliani M, Labardi L, Silvi E, et al. Smokers: risks and complications in abdominal dermolipectomy. Aesthetic Plast Surg 2006; 30: 422–424; discussion 425.