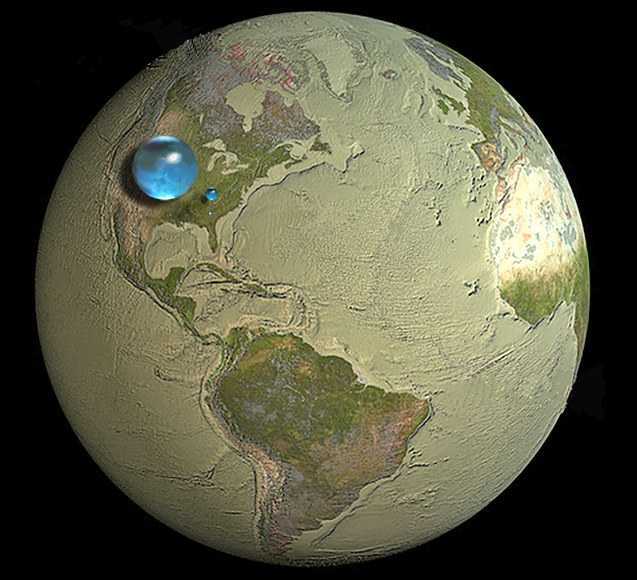
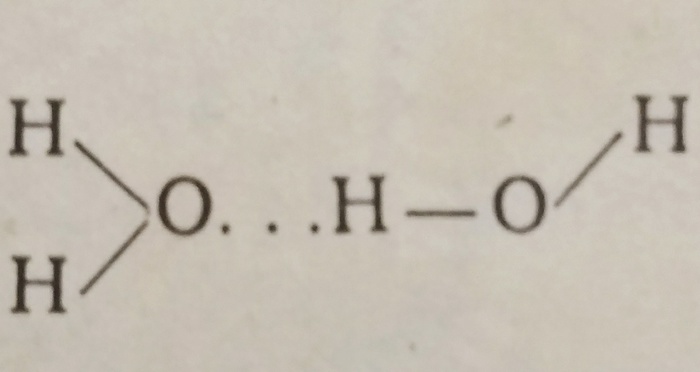Вода. Казалось бы, чего уж проще?
Вода - окисел водорода, содержащий 88.6% кислорода и 11,4% водорода, что отвечает простейшей формуле H²O.
Эта формула знакома всем - даже людям, знающим о химии только понаслышке. Чего уж проще - эта простота уже вошла в поговорку!)
Но так ли проста, вездесущая и всем знакомая вода?
Нет, это далеко не так.
ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ.
Многие физические константы жидкой воды (например, плотность, теплоёмкость) приняты как эталон, образец.
Её температуры плавления и
кипения долгое время служили точками отсчёта cтoградусной шкалы температур по Цельсию(0 °С и100 °С).
Значит ли это, что свойства воды обычны,«образцовы»?
Нет, совсем наоборот!
Трудно найти в природе другое вещество, физические свойства которого были бы так необычны, своеобразны и аномальны.
Давайте забудем всё, что нам известно о воде, и попробуем «открыть» её для себя заново.
Поставим перед собой вопрос: каковы должны быть температуры плавления и кипения воды?
Можно ли ставить такой вопрос?
А почему бы и нет, ведь периодическая
система Менделеева даёт возможность представить себе свойства какого-либо соединения, зная свойства аналогичных соединений элементов той же группы.
Аналоги кислорода - это сера, селен и теллур.
Аналоги Н²0 - это H²S, H²Se и H²Те.
Если построить графики их свойств, идя в периодической системе снизу вверх, то
получится картина, отражающая закономерное изменение температур кипения и плавления гидридов H²Te, H²Se и H²S.
Если продолжить получившиеся линии, то окажется, что при сохранении той же
закономерности - вода должна быть газом, кипеть при —80 °C, вместо +100°С, и замерзать при -100°С вместо 0°С!.
Попробуйте представить себе, что получилось бы, если бы вода вела себя "нормально".
Обратимся к другим аномалиям воды (а их немало).
Так, жидкая вода имеет самую высокую теплоёмкость среди всех жидкостей (1 кал/ (г. град), или по Международной системе единиц СИ 4,19 кДж/(кг - град)].
Аномально и изменение плотности воды.
Плотность других жидкостей, как правило, при понижении температуры постепенно возрастает и становится максимальной при замерзании.
А плотность воды при охлаждении «нормально» возрастает лишь до +4 °С,
достигая 1 г/см³. От +4 °C до 0°C она немного уменьшается.
Плотность же льда
резко, скачком уменьшается до 0,91 г/см3. Теплота плавления льда 332,7 кДж/кг (79,4 кал/г) также аномально высока, она в 13,5 раза выше, чем, например, у свинца.
Как же объяснить необычные свойства воды??
Чтобы ответить на этот вопрос, обратимся к ее молекулярному строению..
Молекула Н²0 нелинейна, угол между связями O-H равен 104,27°. Связи эти ковалентные, но они полярны
(атомы Н несут на себе некоторый положительный заряд,
атомы O - отрицательный).
Поэтому полярна и молекула в целом; она представляет собой диполь.
Дипольные молекулы взаимодействуют сильнее, чем молекулы неполярные.
Но молекулы воды связаны между собой гораздо прочнее, чем можно было бы ожидать, учитывая лишь физическое взаимодействие диполей.
Это объясняется существованием водородных связей.
В водородной связи участвуют атом O одной молекулы и
атом H - другой:
Такие связи гораздо менее прочны, чем ковалентные связи 0-Н внутри молекул, и всё же именно благодаря им взаимодействие молекул в воде гораздо сильнее, чем во многих других жидкостях (например, в жидких H²S, H²Se, H²Te).
В процессе теплового движения молекул водородные связи рвутся, но взамен тут же возникают новые.
Таким образом, в жидкой воде существует
динамическая система межмолекулярных водородных связей.
Иначе говоря, молекулы воды ассоциированы.
Именно повышенная прочность связей между молекулами H²О служит причиной аномально высокой температуры кипения воды.
Сильное межмолекулярное взаимодействие затрудняет переход молекул из жидкости в пар.
В кристаллах льда тоже существуют водородные связи, но здесь система таких связей статична, а следовательно, ещё более прочна, чем в жидкой воде.
Именно в этом причина аномально высокой температуры и теплоты плавления льда.
Рассмотрим теперь структуру льда более
внимательно.
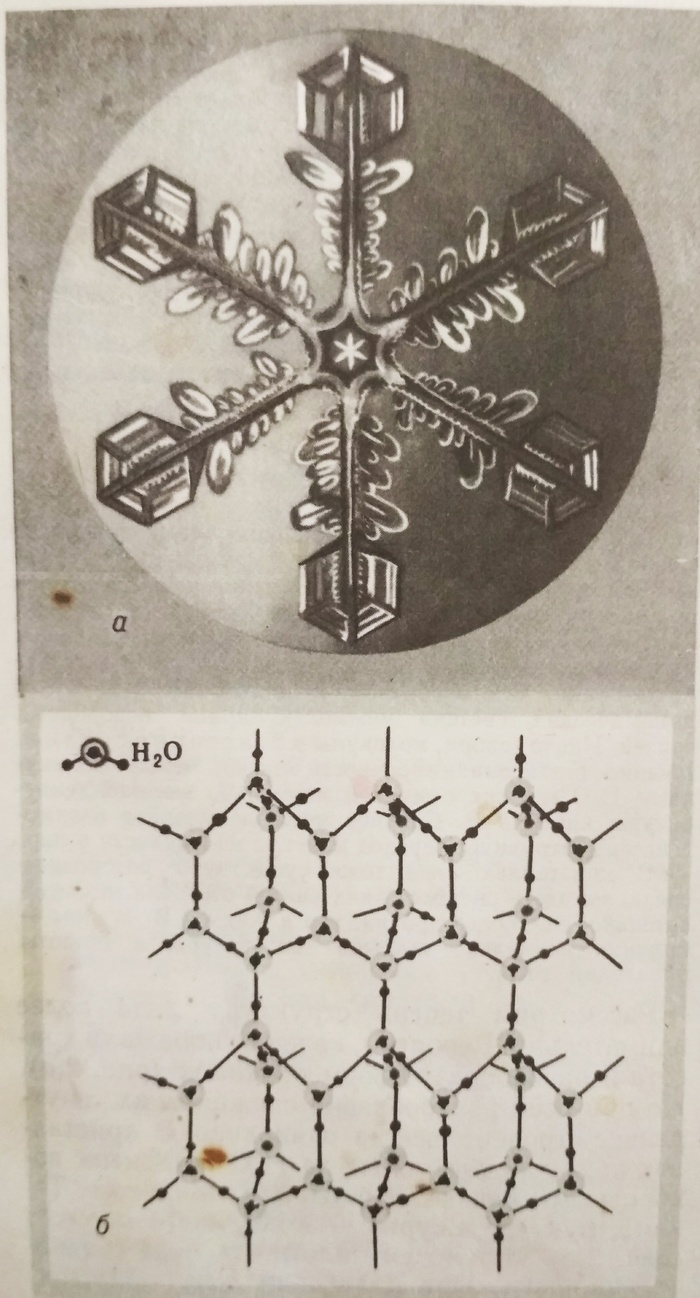
Вероятно, каждого поражали красота и разнообразие форм снежинок.
Но при всём разнообразии снежинок их внутреннее строение ВСЕГДА ОДИНАКОВО.
В кристаллах льда каждая молекула Н²0 соединена водородными связями с четырьмя соседними.
Такая структура ажурна, в ней много «пустот».
Вот почему плотность льда сравнительно низка.
При плавлении льда часть «пустот» заполняется «одиночными», и «сдвоенными» молекулами H²О, уже освободившимися из кристаллической решётки.
Поэтому плотность воды выше, чем у льда.
Такое увеличение плотности продолжается и при нагревании от 0 до
+4 °C.
Но при более высоких температурах начинает преобладать тепловое движение молекул, расстояния между отдельными молекулами H²0 увеличиваются, и изменение плотности становится «нормальным».
Поскольку тепловая энергия при нагревании воды расходуется не только на ускорение движения молекул Н²0, но и на разрыв водородных связей между ними, то и теплоёмкость воды оказывается столь большой.
Кстати, даже в парах воды, при
100 °C эти связи разорваны
ещё не полностью, так что из каждых 200 молекул Н²О примерно 7 попарно связаны между собой.
В виде H²O вода существует и при растворении её в органических растворителях.
Вот как сложна «простая» и обыкновенная вода.
С высокой полярностью молекул Н²О связано большое значение её диэлектрической проницаемости и почти не имеющая себе равных способность растворять другие полярные соединения и вызывать электролитическую диссоциацию кислот, оснований и солей.
И вода и лёд (при их достаточной чистоте) вполне прозрачны и бесцветны. В толстых слоях вода имеет голубоватую окраску, потому что задерживает красную часть спектра световых лучей сильнее, чем синюю (синюю отражает).
Ещё сильнее поглощает вода невидимые инфракрасные (тепловые) лучи это имеет важнейшее значение для температурного режима нашей планеты.
Так как водород имеет 2, а кислород
3 стабильных изотопа, существует 9 различных вариантов соединения их в молекулы воды. (а с учётом радиоактивных изотопов - 36 вариантов).
В природной воде молекулы, состоящие
только из «лёгких» изотопов 1H и 16 O, составляют 99.73 %.
ХИМИЧЕСКИЕ СВОЙСТВА.
Молекула Н²О настолько прочна, что разрушить её можно лишь очень энергичным внешним воздействием.
Разложение воды по обратимой реакции:
2H²О=2Н²+О²
становится заметным лишь при нагревании до 2000 °С (термическая диссоциация).
Оно происходит и под действием ультрафиолетовых лучей (фотохимическая диссоциация).
Радиоактивное излучение разлагает воду с образованием водорода, кислорода, перекиси водорода и очень активных свободных радикалов.
Вода — слабый электролит.
При комнатной температуре лишь одна из 10 млрд. молекул диссоциирует.
Так что при 25 °С в чистой воде концентрации Н+ и OH- составляют всего 10-7 г-ионов/л.
Это соответствует водородному
показателю рН=7.
При повышении температуры электролитическая диссоциация воды усиливается.
При 700 °С и давлении 130000 атм концентрация Н+ становится такой же, как при обычных условиях у 10%-ной соляной кислоты.
Ион водорода Н+ в растворах не существует в свободном состоянии, а присоединяется к молекуле Н²О и образует ион гидроксония Н³О+.
Қак и все другие ионы, гидроксоний в водной среде, в свою очередь, гидратирован, то есть окружён несколькими молекулами H²0.
ПОЛУЧЕНИЕ.
Қазалось бы, разговор об этом
не заслуживает особого внимания: ведь вода - самое распространённое вещество на поверхности Земли.
Но всё дело в том, что нас окружает не чистая вода, а растворы различных веществ в воде.
Даже в самой чистой, по житейским понятиям, воде, «что-нибудь да растворено...».
Абсолютно же чистую воду получить очень и очень трудно.
Дистиллированная вода, полученная конденсацией водяного пара и достаточно чистая для большинства целей, не годится для точных химических исследований. Критерием чистоты воды служит постоянство её свойств, в частности, электропроводности.
Лишь после 35—40 повторных дистилляций воды в вакууме, перестают
изменяться её свойства.
Посуда для перегонки должна быть сделана из кварца.
Самую же чистую воду получают взаимодействием тщательно очищенных водорода и кислорода в присутствии платинового катализатора.
Области применения воды — даже
если говорить только о промышленности -
настолько обширны, что практически невозможно назвать какой-либо производственный процесс, в котором не используется вода.
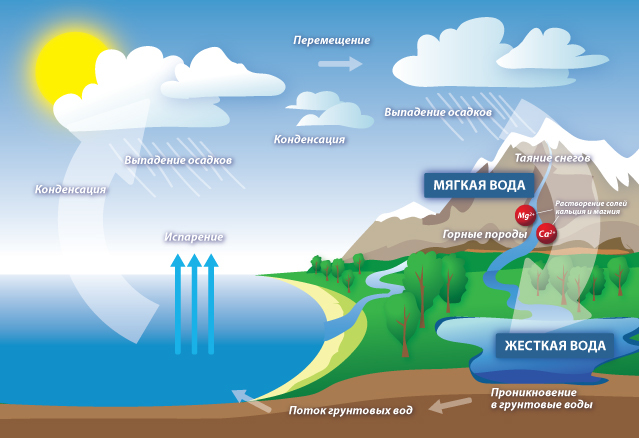
ЖЁСТКОСТЬ ВОДЫ.
Жесткость воды это совокупность свойств, обусловленных содержанием в ней ионов Са2+ и Mg2+.
Если концентрация этих ионов велика, то
воду называют жёсткой, если мала мягкой.
Вы хотите в жёсткой воде помыть голову с мылом? - но пена не образуется.
То же и при стирке белья — жёсткость не только ухудшает качество тканей, но и повышает затраты мыла и стирального порошка.
В обоих случаях мыло (калиевая или натриевая соль
стеариновой кислоты C17H35COOK) расходуется на связывание ионов Са2+ и Mg2+ и осаждается в виде нерастворимых солей.
Пена образуется лишь после полного осаждения этих ионов.
В очень жёсткой воде с трудом развариваются пищевые продукты, а сваренные в ней овощи невкусны;
плохо заваривается чай, теряется его аромат.
При большом содержании ионов
Mg2+ (как в море или океане) вода горьковата на вкус и оказывает послабляющее действие, на кишечник.
Никто из нас не станет пить
такую воду, хотя в санитарно-гигиеническом отношении ионы Са2+ и Mg2+ не вредны.
Непригодна жёсткая вода для использования в паровых котлах.
Растворённые в ней соли при нагревании и испарении воды образуют на стенках котлов слой накипи, который плохо проводит теплоту.
Это ведёт к перерасходу топлива, к преждевременному износу котлов, а иногда из-за перегрева стенок котлов и к аварии.
При кипячении жёсткой воды образуется и накипь в чайниках.
Не годится жёсткая вода и для обогащения полезных ископаемых методом флотации, где применяются олеиновая кислота и другие флотореагенты, образующие малорастворимые соли с Ca и Mg.
Наконец, жёсткая вода вредна для металлических конструкций, трубопроводов, кожухов охлаждаемых машин.
Ионы Са2+ обусловливают кальциевую
жёсткость, а ионы Mg2+ соответственно, магниевую жёсткость.
Общая жесткость воды складывается из
кальциевой и магниевой, то есть из суммарной концентрации ионов Са2+ и Mg2+.
По отношению к процессам умягчения воды различают жёсткость карбонатную и некарбонатную.
Карбонатная жёсткость вызвана присутствием растворённых гидрокарбонатов кальция Са (HCO3), и магния Mg (HCO).
При кипячении гидрокарбонаты разрушаются, образующиеся при этом малорастворимые карбонаты
выпадают в осадок, и общая жёсткость воды уменьшается.
Поэтому карбонатную жёсткость называют также временной.
Водная оболочка Земли гидросфера — составляет около 71% земной поверхности.
В связанном состоянии вода находится и в земно коре — литосфере, причем подсчитано, что запасы такой воды (на секундочку!!) примерно равны массе свободной воды в гидросфере.
Найдено, что 1 км³ гранита при плавлении может выделить 26 млн. тонн воды.
Ещё больше «резервы» В., заключённые в
более глубоких недрах Земли — в мантии.
Считают, что здесь до 13 млрд. км³ воды, то есть, вдесятеро больше, чем в гидросфере.
Но на поверхность вулканы выносят лишь 1 км³ такой воды ежегодно.
Вода играла и играет определяющую роль
в геологической истории Земли, в формировании её теплового режима, климата и погоды.
Сегодня далеко не всё известно об этом интереснейшем, давно знакомом, но во многом загадочном, таком обильном и таком дефицитном веществе, О ПРОСТОЙ ВОДЕ.