Системы CRISPR-Cas в борьбе с инфекционными заболеваниями
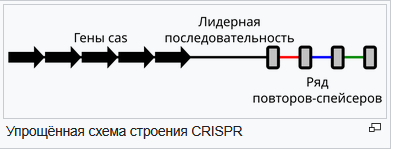
CRISPR системы — это особые локусы бактерий и архей, состоящие из прямых повторяющихся последовательностей, которые разделены уникальными последовательностями (спейсерами). Спейсеры заимствуются из чужеродных генетических элементов, с которыми сталкивалась клетка (бактериофагов, плазмид). РНК, транскрибирующиеся с локусов CRISPR, совместно с ассоциированными белками Cas обеспечивают адаптивный иммунитет за счёт комплементарного связывания РНК с нуклеиновыми кислотами чужеродных элементов и последующего разрушения их белками Cas.
Локусы CRISPR могут выполнять функцию иммунитета только при наличии генов cas, которые обычно располагаются в непосредственной близости от CRISPR. работа систем CRISPR-Cas имеет много общих принципиальных моментов с работой иммунной системы млекопитающих. Так, иммунизацию CRISPR (то есть вставку нового спейсера) может вызвать даже дефектный бактериофаг — подобно тому, как иммунный ответ млекопитающих может развиться и при введении убитого патогена, именно поэтому, методики CRISPR-Cas в основном используются для направленного редактирования геномов и являются перспективным направлением в современной генной инженерии. Начиная с 2023 года, эти методики стали применяться в медицине для лечения наследственных заболеваний. Применение CRISPR-Cas у микроорганизмов позволяет модифицировать их метаболические пути, что открывает возможности для развития новых биотехнологических стратегий. Кроме того, важное значение для биотехнологии имеет создание штаммов технологически важных бактерий, устойчивых к различным фагам за счёт CRISPR-Cas.
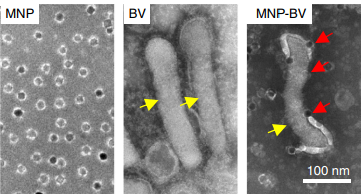
Также CRISPR-Cas имеет значение для адресной доставки лекарств и их высвобождения при внешнем воздействии — для этого используются материалы, в состав которых входят участки ДНК. Информация взята с статьи сайта «N+1»: «Магнитные наночастицы доставили CRISPR точно в опухоль» — https://nplus1.ru/news/2018/11/13/magnet-CRISPR. В данной статье рассказали, как американские биоинженеры разработали подход для адресной доставки компонентов системы редактирования генома при помощи магнита. Для этого ДНК, кодирующую компоненты системы CRISPR-Cas9, они упаковали в вирусные частицы насекомых с покрытием из наночастиц оксида железа, и при помощи магнитной доставки CRISPR, авторам удалось локально сломать ген в опухоли у мышей. Работа была опубликована в Nature Biomedical Engineering.
Упакованные вирусные частицы насекомых с покрытием из наночастиц оксида железа в ДНК с компонентами системы CRISPR-Cas9.
Системы CRISPR-Cas могут передаваться от микроорганизма к микроорганизму с помощью горизонтального переноса генов. Противодействие вторжению в бактерию чужеродных генетических элементов не всегда оказывается полезным для бактерии. Например, у бактерии Staphylococcus epidermidis может наблюдаться снижение устойчивости к антибиотикам, обусловленное уничтожением системой CRISPR-Cas тех конъюгативных плазмид, которые обеспечивали эту устойчивость. У Staphylococcus aureus пониженное количество локусов CRISPR приводит к увеличению числа профагов, плазмид и мобильных генетических элементов в клетке, что усиливает вирулентность бактерии. Однако, локусы CRISPR-Cas, препятствующие распространению полезных в данных условиях мобильных генетических элементов, могут исчезать. Это также может стать полезным для дальнейших разработок.
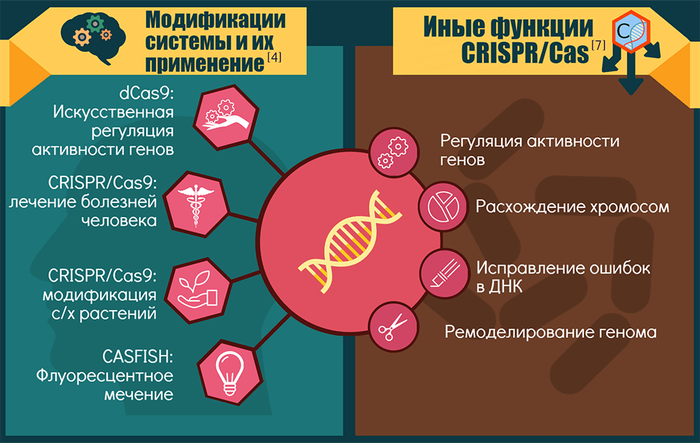
Гомологичная рекомбинация может использоваться для удаления нежелательных мутаций, создания новых аллелей, вставки или слияния функциональных доменов. Инактивированная форма Cas9 (dCas9, «мёртвая» Cas9) служит основой для новых исследовательских приёмов — например, визуализации посредством флуоресценции или создания меток для последующей физической изоляции локусов. Помимо этого, использование dCas9, сшитой с флуоресцентным белком, лежит в основе нового метода CASFISH (флуоресцентной гибридизации, опосредуемой CRISPR-Cas9), который позволяет флуоресцентно метить локусы-мишени. С помощью такой dCas9 можно отслеживать длину теломер, а также наблюдать за динамикой определённых локусов в ходе клеточного цикла.
Несмотря на эффективность использования систем CRISPR-Cas, происхождение Cas9 накладывает некоторые ограничения на выбор ДНК-мишеней. Перед использованием в генетических конструкциях ген Cas9 должен быть предварительно оптимизирован по используемым кодонам в соответствии с организмом, геном которого предполагается модифицировать. В настоящий момент для редактирования генома применяют систему CRISPR-Cas II типа, причём чаще всего используется белок SpyCas9 (нуклеаза Cas9 бактерии S. Pyogenes).
Методы, основанные на CRISPR-Cas, активно находят применение в медицине для лечения самых разнообразных заболеваний: вирусных (в том числе ВИЧ-инфекции и герпесвирусных инфекций), аллергии и иммунологических заболеваний (в том числе аутоиммунных, онкологических, сердечно-сосудистых заболеваний, ревматизма), а также наследственных расстройств — таких, как синдром Дауна, серповидно-клеточная анемия, пигментный ретинит и β-талассемия). Не исключено, что система CRISPR-Cas также может помочь в лечении мышечной дистрофии Дюшенна: показано, что с помощью CRISPR-Cas можно восстановить ген дистрофина в культуре клеток DMD.
Появление технологии CRISPR-Cas9 с её простотой, точностью и эффективностью значительно усовершенствовало процесс редактирования генов. В то же время значительные достижения в разработке технологии CRISPR-Cas9 привели к возникновению проблем в регулировании ее безопасного и этичного использования. В принятом заявлении на Международном саммите по редактированию генома человека была отмечена необходимость в интенсивных фундаментальных и доклинических исследованиях методов редактирования генома в соответствии с надлежащими правовыми и этическими нормами. Широкому внедрению CRISPR терапии в клиническую практику препятствуют риск нецелевого редактирования генома, иммуногенности нуклеаз Cas9 и канцерогенных эффектов компонентов CRISPR, однако это не мешает развиваться системе всё более активно.