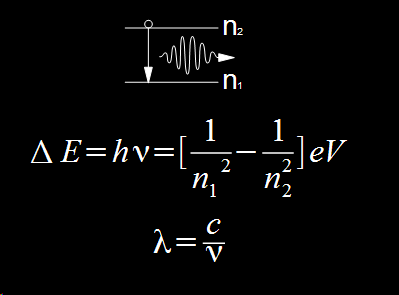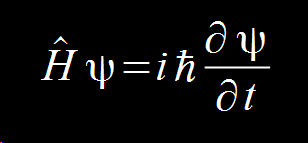Как выглядит атом?
Неизвестно, кто впервые задумался над тем, что если пилить материю на мелкие части неограниченно долго, то рано или поздно дойдёшь до мельчайшей неделимой частицы. Знаем мы лишь то, что был один Древний грек по имени Демокрит, который в свою защиту на судебном процессе по поводу растраты наследства читал отрывки из своего произведения «Мирострой», за что был почему-то оправдан. Суд посчитал, что деньги были потрачены не зря. Во всяком случае, именно ему мы обязаны тем, что та самая мельчайшая частица теперь называется «атом» (ἄτομος по-гречески «неделимый»).
Вопрос оставался чисто философским ещё 22 столетия, пока в 1803 году англичанин Джон Дальтон, не заметил, что расход вещества в химических реакциях всегда кратен целым числам («Кислород может соединяться с определённым количеством азота, или уже с удвоенным таким же, но не может быть какого-либо промежуточного значения количества вещества»), что свидетельствовало о том, что всё состоит из мельчайших неделимых кусочков – атомов, причём, он же первый показал, что атомы разных элементов имеют разный вес.
В 19 веке не было телевизора, поэтому люди старательно пытались его изобрести, для этого они занимались странными вещами – они откачивали воздух из стеклянной трубки с запаянными внутрь металлическими пластинами, затем пропускали по ним электричество. Разреженный газ в трубке начинал светиться. Долго думали, что бы это значило. Кто-то говорил, что это «лучистая материя», кто-то – «эфирные волны»…
Так бы и спорили, пока в 1897 году ещё один англичанин Джозеф Томсон не догадался поставить рядом магнит, и не увидел, что луч отклоняется. Он прикинул, какой массой должна обладать частица, отклоняющаяся на заданное расстояние при известной силе магнита. Оказалось, что она весит в ~1800 раз меньше, чем масса легчайшего известного атома – водорода. Так был открыт электрон – первая субатомная частица. Разумеется, слово атом (неделимый, ха!) менять уже не стали.
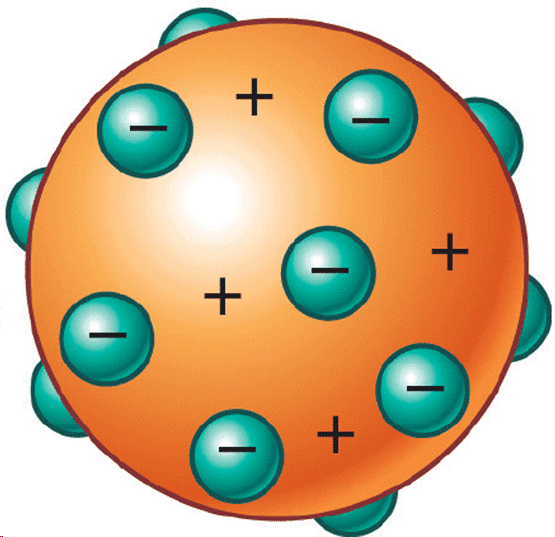
Томсон предложил идею сливового пудинга – есть положительно заряженное что-то, а в него понатыканы открытые им электроны:
Тем временем в Германии…
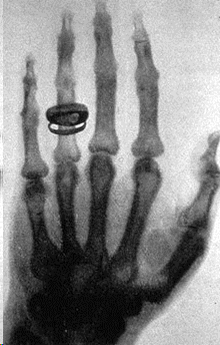
Картинка в первой лучевой трубке (ага, телевизоре) была «не ахти», но это всё равно было лучше, чем ничего, рассудил немец Вильгельм Конрад Рентген, и подставил под катодные лучи руку своего знакомого, получив первый в мире рентгеновский снимок:
Рентген позанимался новой игрушкой год, да и забросил. Интересующимся он отвечал: «Я уже всё написал (про Х-лучи), не тратьте зря время».
Но француз Антуан Анри Беккерель не унимался. Ему пришла в голову мысль: не сопровождается ли всякая люминесценция рентгеновскими лучами? Для проверки своей догадки он взял несколько соединений, в том числе одну из солей урана, фосфоресцирующую жёлто-зелёным светом. Осветив её солнечным светом, он завернул соль в чёрную бумагу и положил в тёмном шкафу на фотопластинку, тоже завёрнутую в чёрную бумагу. Через некоторое время, проявив пластинку, Беккерель действительно увидел изображение куска соли. Но люминесцентное излучение не могло пройти через чёрную бумагу, и только рентгеновские лучи могли в этих условиях засветить пластинку. Беккерель повторил опыт несколько раз и с одинаковым успехом.
2 марта 1896 Беккерель доложил об этом открытии на заседании Парижской Академии наук, озаглавив свою работу «О невидимой радиации, производимой фосфоресцирующими телами».
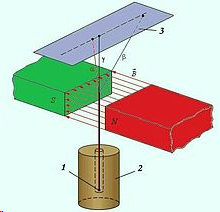
«Хм, а это занятно», подумал английский новозеландец (или новозеландский англичанин) Эрнест Резерфорд (по прозвищу «Крокодил», нет, правда, так его называл советский физик Пётр Капица, который у него работал), подумал, да и пропустил радиоактивный поток через магнитное поле:
1 — радиоактивный препарат, 2 — свинцовый цилиндр, 3 — фотопластинка.
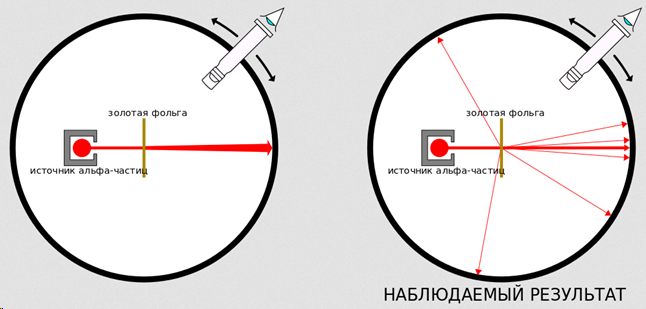
На фотографии он увидел, что пучок распадался на три части. Две составляющие первичного излучения отклонялись в противоположные стороны, что указывало на наличие у них зарядов противоположных знаков. Третья составляющая сохраняла прямолинейность распространения. Излучение, обладающее положительным зарядом, получило название альфа-лучи, отрицательным — бета-лучи, нейтральным — гамма-лучи. Но это сейчас не важно. Важно то, что, помимо всего прочего, он дал позабавиться своим лаборантам Эрнсту Марсдену и Хансу Гейгеру (тому самому, которым ещё счётчик назвали) с золотой фольгой, и вот что получилось:
Ждали, что альфа-частицы будут беспрепятственно проходить сквозь фольгу, однако они то и дело отскакивали. Необъяснимое, количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры, в нём сосредоточен значительный электрический заряд и масса атома. Это неспроста, подумал Резерфорд, и начал считать. Получилось, что внутри атома электроны, стало быть, не плавают в положительно заряженном тумане, а болтаются вокруг крохотного ядра. Это было в 1913 году.
Резерфорд продолжал опыты и к 1919 году, стреляя альфа-частицами в воздух, смог доказать, что так или иначе, ядро атома водорода присутствует во всех других атомах. Это была первый задокументированный случай в истории ядерной реакции, проведённой человеком. Поскольку в воздухе полно азота, альфа-частица попадала в атом азота, превращая его в атом кислорода 17. Замечательным было то, что от удара из атома вылетало ещё и ядро атома водорода, который назвали протон (греч. πρῶτος — первый, основной).
¹⁴N + α → ¹⁷O + p
Ну, и именно благодаря Резерфорду мы теперь имеем вот это:
Иначе говоря «Планетарная модель атома», которая устарела, не успев появиться на свет. Но и теперь, спустя 100 с лишним лет, когда кому-то надо нарисовать атом, рисуют вот эти вот три овальчика. В этой модели вокруг центрального и относительно маленького положительно-заряженного ядра подобно планетам вращались отрицательно-заряженные электроны.
Но что-то по-прежнему не сходилось. Атомы имели нейтральный электрический заряд, а если просто сложить массы протонов так, чтобы их заряд уравновешивал заряд электронов, то атомы должны были быть гораздо легче. Это не соотносилось с атомными весами элементов, которые были известны уже под сотню лет, со времён Дальтона.
Интрига тянулась до 1932 года, когда англичанин Джеймс Чедвик подтвердил существование последней составляющей атома – нейтрона, но это уже совсем другая история.
Вообще сам Резерфорд понимал, что не всё так гладко с его моделью. Если б всё было так, то непонятно, почему электрон не падает на ядро, ведь, двигаясь по «орбите» (а это движение с ускорением), электрон должен был терять кинетическую энергию и испускать фотоны…
Тут нужно сказать, что незадолго до этого момента Макс Планк наделал много шума со своими квантами. Он предположил, что свет (электромагнитное излучение) может передаваться не как угодно, а лишь определёнными порциями «квантами». Так он придумал константу имени себя h, которая связывала энергию световой частицы (фотона) с его частотой. Заметили? У частицы появилась частота, как у волны. Ну, и как бы намекнул, что фотон – это и частица и волна одновременно.
На сцене появляется ещё один человек – Нильс Бор, сын банкира, брат серебряного финалиста сборной Дании по футболу на Олимпиаде 1908 г., да и сам футболист. Его рассуждения были просты – надо не отрицать очевидное, а смириться с ним. Раз атом стабилен, значит, электроны, находясь на определённых «орбитах», стабильны и не излучают.
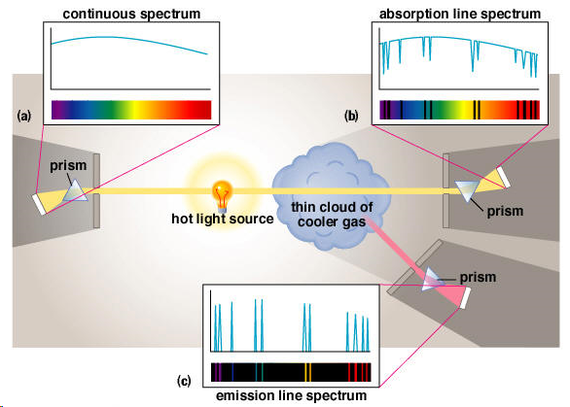
Слева свет беспрепятственно попал на призму и разделился на непрерывный спектр. Справа сверху свет проходит сквозь облако газа, и спектр получился с тёмными полосками (часть световых волн была поглощена). Снизу газ уже не подсвечивается, по мере того, как газ остывает, мы увидим отдельные цветные полоски – это фотоны, которые излучает остывающий газ. Думаю, все видели, как светится нагретый кусок металла, здесь природа такая же.
Ещё покрутив туда-сюда формулы, Бор так же обнаружил, что электроны могут иметь только такую энергию, при которой их момент импульса равен только целому числу констант Планка. То есть, рассудил Бор, электрон может иметь только определённые, «разрешённые» уровни энергий. Если электрон встречается с фотоном нужной энергии (с нужной длиной волны), он сможет его поглотить и перескочить «вверх» на следующий уровень, а если энергии будет чуть больше или чуть меньше, то ничего не произойдёт. И наоборот, поскольку электрон может перескочить только на «разрешённый» уровень, значит, и отдать он должен фотон лишь определённой энергии (частоты):
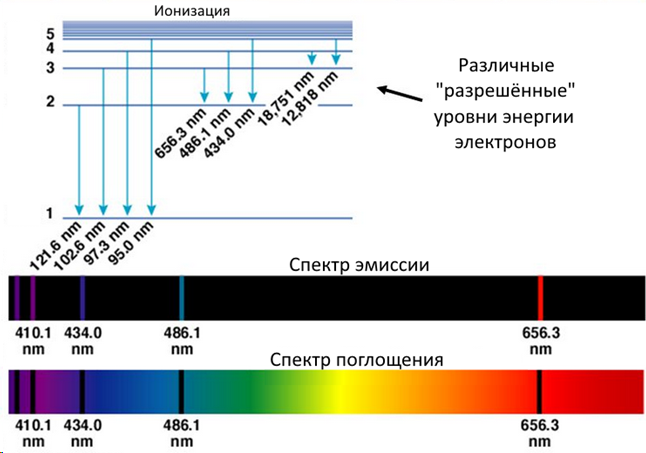
Если посмотреть на спектры эмиссии и поглощения водорода, можно будет рассчитать уровни энергии для всех возможных переходов с уровня на уровень для любого атома. Внизу на картинке – пример с водородом:
Модель Бора отличалась от модели Резерфорда лишь «закреплением» определённых «разрешённых уровней возбуждения, однако объяснить природу подобных запретов она не смогла. Не была эта модель и универсальной: для атомов, похожих на водород, она ещё могла предсказать их строение, которое соотносилась с экспериментальными данными, однако для других атомов, предсказания по модели Бора серьёзно отличались от данных, полученных на спектрометре. А разгадка одна – Бор пользовался классической теорией Максвелла, и не догадался применить квантование на массивные частицы (так как это сделал Планк для фотонов – частиц, не имеющих массы)…
А вот француз Луи Де Бройль смог!
И вот, что он придумал – он сказал, «пусть электрон тоже будет волной»! Тогда получается всё просто, никто электронам ничего не разрешает и не запрещает, просто на «орбите» должно вместиться целое число волн:
От Де Бройля действительно потребовались чудеса нестандартного мышления, чтобы в то время приписать волновые свойства электрону – явно частице, имеющей массу и заряд. Но и его модель атома страдала той же проблемой – почему отрицательный электрон просто не «падает» на положительное ядро? В рамках классического механики, подобное движение по «орбите» непременно должно было заставить электроны отдать всю свою энергию и упасть.
Ответ стал очевидным в 1926 году для австрийца Эрвина Шрёдингера – наверное, этого не происходит потому, что никаких «орбит» не существует, а электроны не вращаются! Если электроны – это волны, причём такие, которые могут «квантоваться», то есть существовать лишь определёнными «порциями», то почему бы нам не воспринимать вообще ВСЕ известные частицы как волны?
Раз так, нам понадобится какое-то новое уравнение вместо уравнений Ньютона, которое смогло бы помочь предсказать их поведение. Что-то вроде уравнений Максвелла, только для всех частиц!
Мы назовём нашу волновую функцию ψ Мы возьмём полную энергию частицы H, которую назовём Гамильтониан (Hamiltonian) и посмотрим, как она изменяется за время t:
Это уравнение будет содержать все волновые формы частицы. Собственно, это и есть знаменитое уравнение Шрёдингера в его наиболее общей форме.
Внимание, ОБМАН! Картинка с волнистыми траекториями не отражает действительное положение вещей и всё сильно упрощает. Никаких волнистых траекторий электрон на самом деле не описывает. А что же тогда «волнуется», что это за волны такие?
На что немец Макс Борн в том же 1926 году со всей ответственностью заявил: это волны вероятности! Вероятность нахождения электрона в том или ином месте. Здесь необходимо вспомнить отца квантовой механики Вернера Гейзенберга и его принцип неопределённости (ссылка на пост про него) – если вы знаете импульс частицы (куда она летит), вы не знаете, где она находится, если же вы знаете её месторасположение, вы не знаете её импульса. Все промежуточные состояния можно оценить только с определённой ВЕРОЯТНОСТЬЮ.
В конечном счёте мы приходим к неутешительному выводу, атом может выглядеть практически как угодно. На рисунке ниже показаны все возможные конфигурации нахождения электрона в простейшем атоме водорода. Более ярким цветом выделены области, где вы с наибольшей вероятностью сможете найти электрон, однако это не значит, что он там есть.