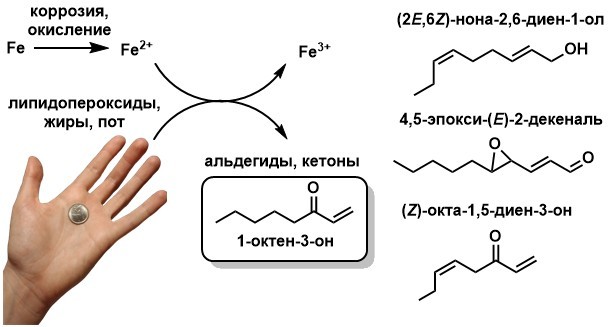
Дисклеймер: пост адресуется в основном студентам-химикам, а также может быть интересен для тех, кто когда-либо задавался вопросом, а чем вообще занимаются эти химики в своих лабораториях?!
Итак, представим себе, что вы химик-органик и только что синтезировали очередное нечто. Казалось бы, самое главное позади, вы получили желаемый продукт. Но что это? Вы видите перед собой колбу с непонятной коричневой кашей, когда вообще-то тут должны быть «белые кристаллы».
Итак, начинается самый нелюбимый этап любого органика – выделение чистого вещества. А вы думали, все так просто – смешал одно, другое, погрел – и вот вам продукт на блюдечке? До этого еще надо пройти несколько кругов ада.
Первый круг ада этап выделения – определение того, какой метод вам подходит.
Большие количества вещества, начиная с граммов (да, 1 г – это уже много, когда мы говорим о всякой тонкой химии и биологически активных веществах), в зависимости от их агрегатного состояния (жидкое, твердое, хрен пойми какая каша) можно очистить перегонкой или перекристаллизацией.
Но чаще всего в научно-исследовательских лабораториях работают с количествами измеряемыми сотнями мг и меньше. Для таких масштабов упомянутые методы едва ли подойдут. И тут на помощь приходит она, Хроматография.
Хроматография – это метод разделения смесей, основанный на различии в распределении различных веществ между подвижной и неподвижной фазой. Подвижной фазой может быть жидкость или газ, тогда говорят соответственно о жидкостной или газовой хроматографии. Неподвижная фаза может быть твердой (чаще всего), либо жидкой, нанесенной на инертный носитель. Хроматографические методы широко используют для анализа и идентификации веществ. Но мы сфокусируемся на том, как можно использовать хроматографию для практических целей в лаборатории.
Предположим у вас есть 200 мг какой-то смесѝ, которую вы бы хотели разделить. Первое, что можно с этим сделать – поставить ТСХ (тонкослойная хроматография). ТСХ поможет вам увидеть, насколько все плохо сложная у вас смесь и есть ли там интересующее вас вещество. Действо это заключается в следующем: маленькая капля раствора с вашими веществами с помощью тонкого капилляра или микрошприца наносится на специальную пластинку с тонким слоем адсорбента. Для проверки рядом можно поставить растворы стандартов, чаще всего исходников или вероятного продукта. Затем пластинку помещают в камеру с нашей будущей подвижной фазой – элюентом, так чтобы пятно с нашим веществом находилось слегка над уровнем жидкости:
Дальше жидкость, поднимаясь вверх по пластинке за счет капиллярных сил (так же как и чай по нитке от заварочного пакетика), уносит за собой нанесенные вещества, НО! не все одинаково. Чем сильнее вещество цепляется за пластинку (адсорбируется), тем сложнее его смыть и тем ниже на пластинке оно оказывается.
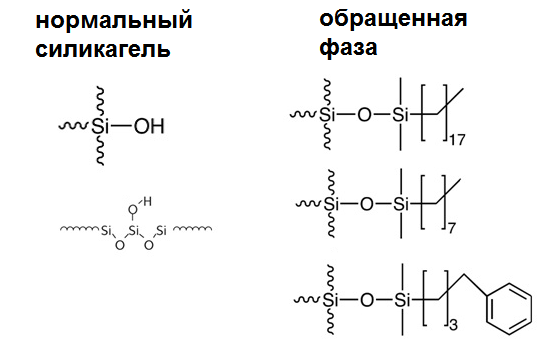
Что удерживает вещество на пластинке? Поскольку наш адсорбент – силикагель – содержит свободные группы –ОН, он может связывать вещества за счет водородных связей или дипольных взаимодействий. Прочнее всего будут удерживаться кислоты, и разные штуки, содержащие ОН и NH группы, в общем говоря - полярные вещества. Разные неполярные вещи, алканы например, почти не задерживаются и уходят с фронтом элюента (не забыли, что это такое?).
Для оценки качества разделения используют такую штуку как Rf (Retention factor), которая показывает, насколько далеко вещество уползло. На картинке Rf – это отношение a/b (a – расстояние от точки старта до центра пятна, b – от старта до фронта). Для разделения оптимально Rf основного вещества 0.3-0.5, а также важно, чтобы все остальные пятна расходились от него как можно дальше и не перекрывались.
Как же сделать так, чтобы все разделилось, да еще и оказалось там, где нужно?
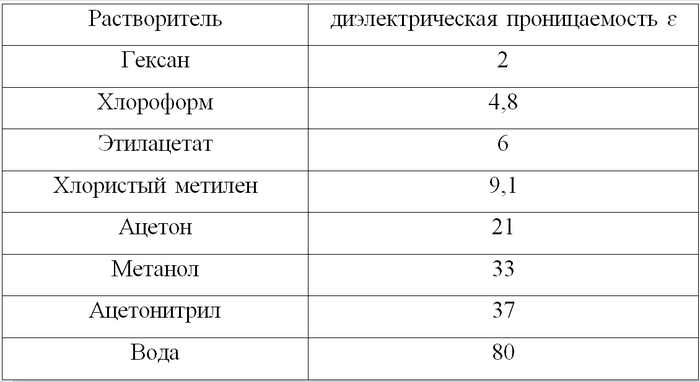
Это решается долгим и кропотливым подбором элюента (подвижной фазы). Общее правило - чем более полярное вещество, тем более полярным должен быть и элюент.
Среди самых неполярных - гексан или петролейный эфир. Для повышения полярности его можно смешивать с другими жидкостями – этилацетатом, хлористым метиленом, спиртом. В самых тяжелых случаях добавляют так называемый модификатор – очень малое количество, порядка процента, очень полярного компонента: уксусной кислоты, метанола или триэтиламина. Такой ход позволяет выгнать с пластинки даже кислоты и амины.
В общем полярность элюента коррелирует с его значением диэлектрической проницаемости:
Так, а теперь как говорится
Технические вопросы и замены
Не для всех случаев разделения подойдет обычный силикагель в качестве адсорбента. Тогда используют обращенную фазу – силикагель с пришитыми к нему длинными гидрофобными (неполярными) хвостами. Из названия можно догадаться, что и порядок выхода веществ на таком адсорбенте будет обратный: сначала выйдет все самое полярное, слабо или не взаимодействующее с носителем. Соответственно, элюент для такой фазы должен быть очень полярным – вплоть до воды и ацетонитрила. Обращенная фаза просто незаменима для тех, кто часто делит кислоты или амины, потому что смыть их с обычного силикагеля – та еще задача.
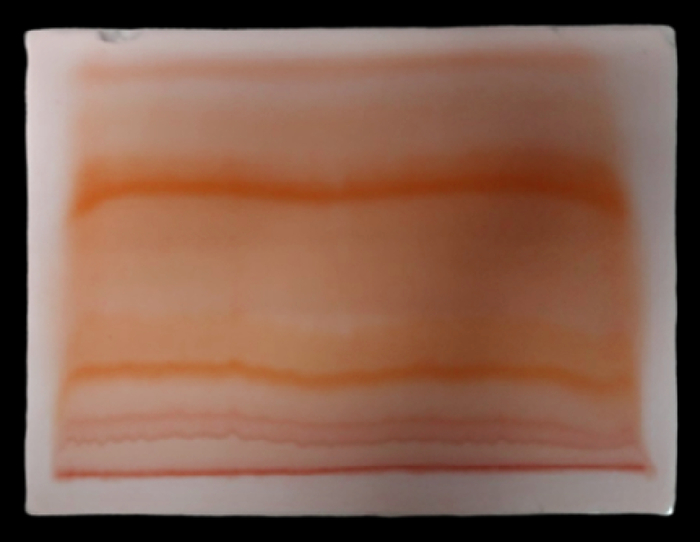
Те, кто делит пигменты и красители, могут воспользоваться самым простым методом ТСХ – бумажной хроматографией. Соответственно, все то же самое, но на специальной бумажной полоске:
К сожалению , не все вещества так хорошо видны. Зачастую чтобы увидеть картину разделения необходимо еще поколдовать над проявлением ТСХ.
Самые распространенные и простые методы проявления:
-Поместить пластинку в йодную камеру: большинство органики проявится в виде коричневых пятен. Йод обладает высоким сродством как к ненасыщенным и к ароматическим соединениям.
-УФ-свет: как мы уже видели, пятна веществ на пластинке остаются темными из-за поглощения света этих длин волн. Лучше всего видны ароматические и системы с сопряженными связями. Для удобства пятна можно обвести карандашом, и в таком виде вклеить ТСХашку себе в лабжурнал.
-Раствор марганцовки перманганата калия. Отлично подходит для веществ, чувствительных к окислению. Алкены и алкины легко проявляются на пластинке в виде ярко-желтого пятна на ярко-фиолетовом фоне. Спирты, амины, сульфиды, меркаптаны и другие окисляемые штуки также могут быть видны, но для этого нужно будет еще осторожно нагреть пластинку ТСХ после погружения в раствор. Эти пятна будут выглядеть как желтые или светло-коричневые на светло-фиолетовом или розовом фоне. Опять же было бы выгодно обвести такие пятна после проявления, поскольку при долгом стоянии ТСХ выцветет.
Также универсальным проявляющим реагентом считется фосфомолибденовая кислота (РМА). Вещества в ней проявляются темно-зелеными пятнами на светло-зеленом фоне при нагревании.
Для особых случаев, например, если хотят не только определить, где есть вещество, но еще и узнать, к какому классу соединений оно относится, готовят специфические проявляющие реагенты. N,N-Диэтиланилин (DEA) проявляет окисляющие вещества, например, пероксиды, а также нитросоединения. 2,4-Динитрофенилгидразин (DNPH) – реагент для визуализации кетонов и альдегидов. Он образует с ними яркие гидразоны, чаще всего желтые или оранжевые.
Есть и другие специфичные реагенты, такие как хлорид железа (III) – для фенолов; ванилин или пара-анисовый альдегид – для альдегидов, кетонов и спиртов; бромкрезоловый зеленый – для кислотных соединений.
Что еще?
ТСХ – это удобный способ следить за ходом реакции. Можно смотреть за тем, как убывают исходники и появляются новые пятна, а в реакциях восстановления двойной связи – как вещество перестает проявляться в перманганате.
А дальше что?
Теперь, когда первый этап успешно пройден, т.е. подобран элюент и способ детектирования, можно спокойно переходить непосредственно к разделению.
Об этом – в следующих постах, a пока можете посчитать, какой Rf на 4-й картинке и ответить на вопрос: а зачем у ТСХашек снизу обрезаны уголки.